这一发现可以解释为什么女性更容易患老年痴呆症
斯克里普斯研究所和麻省理工学院(MIT)的科学家们发现了阿尔茨海默病分子成因的线索——这条线索或许也能解释为什么女性患这种疾病的风险更大。
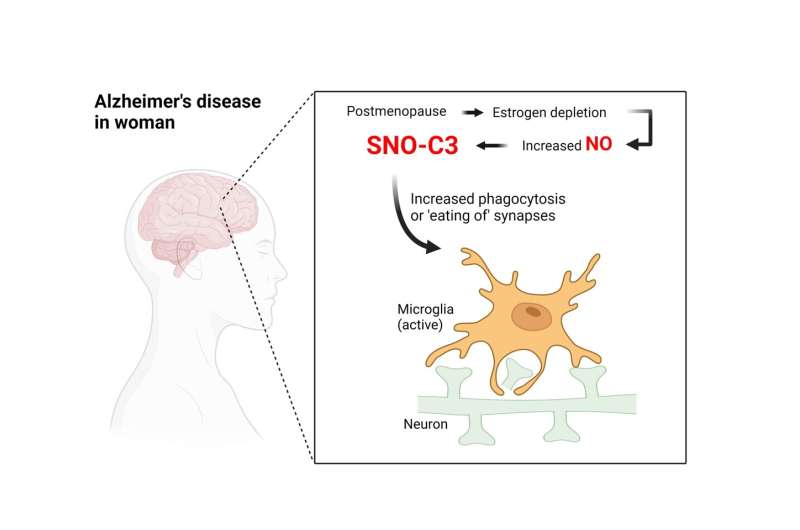
该研究报告于2022年12月14日发表科学的进步研究人员发现,与死于该疾病的男性相比,死于该疾病的女性大脑中存在一种特别有害的、被称为补体C3的炎症免疫蛋白的化学修饰形式,其水平要高得多。他们还表明,雌激素——在绝经期间分泌量下降——通常会阻止这种形式的补体C3的产生。
“我们的新发现表明,补体系统的一个组成部分的化学修饰有助于驱动阿尔茨海默氏症,并且可以解释,至少部分地,为什么这种疾病主要影响女性,”研究资深作者Stuart Lipton说,他是斯克里普斯研究中心分子医学部门的教授和Step Family Foundation捐赠主席,也是加州拉霍亚的临床神经学家。
这项研究是与麻省理工学院安德伍德-普雷斯科特生物工程、化学和毒理学终身教授史蒂文·坦南鲍姆博士领导的团队合作进行的。
阿尔茨海默氏症是随着年龄增长而发生的最常见的痴呆症,目前正在折磨着人们大约600万人仅在美国。它总是致命的,通常在发病后的十年内就会致命,而且目前还没有得到批准的治疗方法可以阻止这种疾病的发展,更不用说逆转它了。治疗方法的缺点反映了一个事实,即科学家们从未完全了解阿尔茨海默氏症是如何发展的。科学家们也不完全清楚为什么女性占了近三分之二的病例。
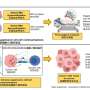
利普顿的实验室研究可能导致这种情况的生化和分子事件神经退行性疾病包括形成修饰型补体c3的化学反应,这一过程被称为蛋白质s -亚硝基化。利普顿和他的同事们之前发现了这种化学反应,当一个一氧化氮(NO)相关分子与蛋白质的特定氨基酸构建块上的硫原子(S)紧密结合,形成修饰的“sno蛋白”。由小簇原子(如NO)引起的蛋白质修饰在细胞中很常见,通常会激活或使a失活靶蛋白的功能。由于技术原因,s -亚硝基化比其他蛋白质修饰更难研究,但利普顿怀疑这些蛋白质的“sno风暴”可能是阿尔茨海默氏症和其他神经退行性疾病的关键因素。
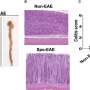
在这项新研究中,研究人员使用了检测s -亚硝基化的新方法来量化40具尸体中修饰的蛋白质人类的大脑.一半的大脑来自死于阿尔茨海默氏症的人,另一半来自没有死于阿尔茨海默氏症的人——每一组的男女比例都是一样的。
在这些大脑中,科学家们发现了1449种不同的蛋白质被s -亚硝基化。在最常以这种方式修饰的蛋白质中,有几种已经与阿尔茨海默氏症有关,包括补体C3。引人注目的是,女性阿尔茨海默病患者大脑中s -亚硝基化C3 (SNO-C3)的水平是男性阿尔茨海默病患者大脑的六倍多。
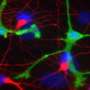
补体系统是人类免疫系统中进化较早的部分。它由包括C3在内的一系列蛋白质组成,这些蛋白质可以相互激活,从而在所谓的“补体级联”中引发炎症。30多年前,科学家们就已经知道,与神经正常的大脑相比,阿尔茨海默氏症患者的大脑中有更高水平的补体蛋白和其他炎症标志物。最近的研究已经明确地表明,补体蛋白可以触发一种叫做小胶质细胞的脑内免疫细胞来破坏突触——神经元相互传递信号的连接点。许多研究人员现在怀疑,这种突触破坏机制至少在一定程度上是阿尔茨海默病过程的基础,突触的丧失已被证明是阿尔茨海默病大脑认知能力下降的重要相关因素。
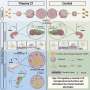
为什么SNO-C3在患有阿尔茨海默病的女性大脑中更常见?长期以来一直有证据表明,雌性激素雌激素在某些情况下可以起到脑保护作用;因此,研究人员假设雌性激素可以保护女性大脑免受C3 -亚硝基化的影响,而当雌性激素水平随着更年期急剧下降时,这种保护作用就会消失。用培养的人类脑细胞进行的实验支持了这一假设,发现SNO-C3随着雌激素(β-雌二醇)水平的下降而增加,这是由于一种使NO进入的酶的激活大脑细胞。SNO-C3的增加激活了突触的小胶质细胞破坏。
利普顿说:“为什么女性更容易得阿尔茨海默氏症一直是个谜,但我认为我们的研究结果代表了一个重要的谜团,从机械上解释了女性随着年龄增长而变得越来越脆弱的原因。”
他和他的同事们现在希望对去亚硝基化化合物进行进一步的实验——去除SNO修饰——看看它们是否能减少阿尔茨海默氏症动物模型的病理,最终在人类身上。
“基于异常的阿尔茨海默病中女性优势的机制洞察蛋白质C3的s -亚硝基化”,由麻省理工学院的杨红梅、Haitham Amal、John Wishnok、Sarah Lewis和Steven Tannenbaum共同撰写;以及Scripps Research的Oh Chang-ki、Emily Schahrer、Dorit Trudler、Tomohiro Nakamura和Stuart Lipton。