利用人类iPS细胞,科学家在一些患者身上发现了导致ALS的基因变异
日本名古屋大学的研究人员在一些肌萎缩性侧索硬化症(ALS)患者身上发现了一种新的遗传变异。利用人类诱导的多能干细胞,他们详细描述了这种变体与ALS相关的过程。研究人员希望这种机制能够成为ALS治疗的一个新的治疗靶点。研究结果发表在神经科学杂志.
渐冻症是一种进行性的致命神经退行性疾病,患者会逐渐失去运动神经元并出现肌肉无力。这种疾病的机制和原因尚不清楚,也没有治疗方法。此外,渐冻症是一种多样化的疾病;不同的病人似乎有不同的病因、机制和症状。研究人员知道,一种叫做融合肉瘤(FUS)的蛋白质在这种疾病中起着关键作用。通常情况下,FUS与RNA结合并调节RNA的功能。另一方面,FUS功能障碍与各种神经退行性疾病有关,包括ALS。
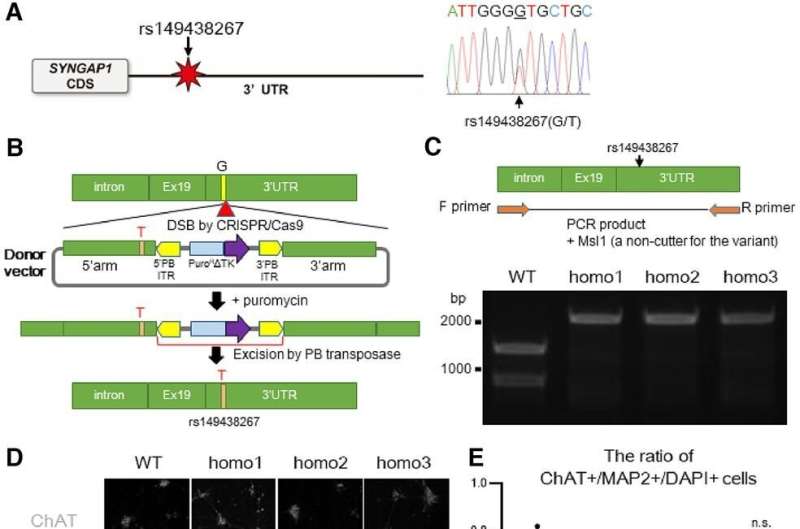
名古屋大学医学院神经学系的Satoshi Yokoi博士和他的同事一直在研究这种FUS蛋白。此前,他们发现FUS蛋白与编码SYNGAP1蛋白的RNA相互作用。SYNGAP1有助于突触的形成,这对神经元协同工作至关重要。“目前还没有研究报道SYNGAP1参与ALS的发病机制。然而,鉴于SYNGAP1与FUS的密切关系,我们想调查SYNGAP1是否与ALS有任何关系,”该研究的主要作者Yokoi博士说。
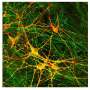
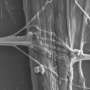
首先,研究小组在渐冻症患者身上寻找SYNGAP1基因的变体。他们发现807名患者中有7人携带该变异。接下来,为了检查SYNGAP1变异的行为,他们在人类ips衍生的运动神经元中复制了这种变异基因。
iPS细胞是一种干细胞,科学家可以将其转化为人体内任何类型的细胞,包括神经元。它在……中特别有用ob欧宝直播nba因为研究人员可以产生,例如,患病细胞,并在活的状态下对它们进行不同的测试。
这与研究人员在动物细胞或活体体外进行测试的传统方法形成了鲜明对比。
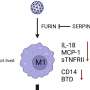
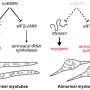
在这项研究中,研究人员从iPS细胞中生成了SYNGAP1变异的运动神经元。在这些神经元中,研究人员观察到一些与正常运动神经元相比的异常行为。特别是,该变体过度招募FUS蛋白,以及另一种称为HNRNPK的rna结合蛋白。这种过度的结合抑制了突触的形成。
特别是,过度募集HNRNPK,而不是FUS,似乎是SYNGAP1变异突触功能障碍的主要原因。此外,当研究人员应用反义RNA阻止HNRNPK与SYNGAP1 RNA的过度结合时,他们恢复了突触的形成,这意味着运动神经元可以一起工作。这表明,在未来,科学家可以利用反义RNA来开发ALS药物。
HNRNPK与SYNGAP1过度结合导致突触异常,这解释了早期ALS发生突触丢失的过程。此外,虽然之前的ALS研究主要集中在FUS,但本研究强调了SYNGAP1和HNRNPK的关键作用。目前研究中使用的反义RNA仅对那些患有糖尿病的患者有效变体SYNGAP1。尽管如此,研究人员希望这种新机制的发现可以为其他类型的ALS提供新的见解。
有趣的是,这项研究还发现SYNGAP1在人类iPS细胞中的表现与人类iPS细胞不同小鼠模型该基因曾用于SYNGAP1的研究。Yokoi博士说:“我们认为,使用来自人类的样本是至关重要的,这样从这些细胞中观察到的结果就可以直接应用于患者。”
虽然研究人员描述了ALS的一种机制,但由于ALS涉及多种不同的机制和原因,还有许多有待研究的地方。“在我的日常实践中,我见过的渐冻症患者还没有接受治愈性治疗。我们将继续研究,以找到可以应用于未来ALS治疗的东西,”横井博士说。