针对tau蛋白,阿尔茨海默病背后的另一种蛋白质
去年11月,研究人员报告称,lecanemab药物可以减缓阿尔茨海默病的进展。效果不大,但却引起了极大的兴奋,因为这是第一次有药物被证明能够影响这种无情的、无法治愈的疾病的病程。
这种名为lecanemab的药物是一种人造抗体,可以帮助清除溃疡异常蛋白质叫做β -淀粉样蛋白,它形成不溶性的团块叫做淀粉样斑块周围大脑细胞.据认为,淀粉样蛋白引发并维持脑细胞的破坏,从而导致认知能力下降最终导致阿尔茨海默氏症患者患上痴呆症。
但许多研究人员认为,要想对阿尔茨海默病的病程产生重大影响,他们还必须瞄准第二种蛋白质,这种蛋白质迄今为止还没有像β -淀粉样蛋白那样受到那么多的关注,这种蛋白质被称为tau。
华盛顿大学医学院老年学和老年医学部医学教授布莱恩·克雷默(Brian Kraemer)说:“淀粉样斑块会引发疾病级联,所以尝试消除它们是有道理的,但杀死细胞的是tau蛋白。”
克雷默专门研究由tau蛋白引起的神经退行性疾病,称为tau病。其中包括一长串无法治愈的神经退行性疾病。在某些情况下,异常的tau蛋白似乎是疾病的主要原因。这些被称为纯粹的牛头病变。它们包括额颞叶变性,进行性核上性麻痹和匹克病。另一方面,阿尔茨海默氏症被称为混合性tau病,因为β-淀粉样蛋白起作用。
Tau蛋白,与“哇”押韵,稳定细胞内的关键结构,称为微管。这些结构充当细胞的内部骨架,并充当细胞将物质从一个地方运送到另一个地方的管道。
在阿尔茨海默病和其他tau病中,tau蛋白是有缺陷的。它从微管分离出来,在细胞内形成不可溶的聚集物,称为神经纤维缠结。微管的破裂和神经原纤维缠结的积累会破坏脑细胞的功能,最终导致细胞死亡。
克雷默说:“如果我们要针对阿尔茨海默病中的任何一种疾病,我们可能应该针对tau。”“这与认知功能障碍的下降关系最密切。你想去除淀粉样蛋白但你真正想要的是保持认知能力。这需要以tau为靶点。”
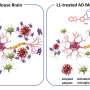
在杂志上发表的一篇文章中美国国家科学院院刊12月26日,Kraemer和他的团队以及主要作者Randall Eck(华盛顿大学神经科学研究生课程的学生)报告了一种蛋白质的鉴定,这种蛋白质似乎对形成异常的tau蛋白收集至关重要。科学家们表明,通过阻断蛋白质生产所需的基因,有可能防止动物模型中tau蛋白的积累。
这种蛋白被称为斑点型POZ蛋白(SPOP)。这个名字指的是它是如何在细胞中的斑点状隔间中被发现的,以及它含有一种被称为POZ结构域的特定氨基酸。这是克雷默和他的同事发现的几种与牛头病有关的蛋白质之一。另一种被称为SUT-2的tau病抑制因子,正在探索其治疗潜力。
这种蛋白质在涉及tau的疾病中所起的确切作用尚不清楚。但它似乎参与了细胞处理和消除缺陷蛋白的基本过程。研究结果表明,如果能够开发出抑制这种蛋白质作用的药物,就有可能治疗阿尔茨海默病和其他牛头病。
为了识别这些关键的调控蛋白,Kraemer和他的同事使用了一种动物模型他的实验室创建于20年前。该模型是一种小型蠕虫的基因工程版本,通常在土壤中发现,称为秀丽隐杆线虫(Caenorhabditis elegans),简称C. elegans。秀丽隐杆线虫的寿命只有三周左右,因此它是研究基因突变如何影响生物体整个生命周期的生长、发育和功能的理想方法。
为了创建这个模型,Kraemer和他的团队引入了人类基因让tau蛋白进入蛔虫体内。
在他们的实验中,科学家们已经证明,改变后的蠕虫出现了人类tau病中的许多异常:不溶性tau的积累,进行性神经细胞死亡,行为缺陷和寿命缩短。
然后,研究人员对蠕虫中的所有基因进行了筛选,看看随机敲除其中任何一个基因是否可以防止这些变化。这种方法使他们首先确定了SUT-2基因,最近又确定了SPOP基因。
Eck说:“当我们在我们的tau蠕虫模型中消除SPOP蛋白时,我们看到tau的积累和渐进性神经细胞死亡的显著减少,以及行为缺陷和寿命的改善。”
Kraemer, Eck和该领域的其他研究人员现在正在研究他们在秀丽隐杆线虫模型中的发现是否可以转化为人类的治疗方法。第一步是观察抑制这些基因是否能在疾病小鼠模型中产生类似的保护作用。抑制SUT-2基因的研究很有希望,针对SPOP的研究正在进行中。
克雷默说:“我们在开发治疗阿尔茨海默病的有效药物方面仍然处于早期阶段。”“tau抑制剂可能足以治疗单纯的tau病,但对于阿尔茨海默氏症,我认为我们必须同时治疗tau和淀粉样蛋白才能获得有效的治疗方法。”