为了引发克罗恩病,致病菌利用了一种遗传易感性
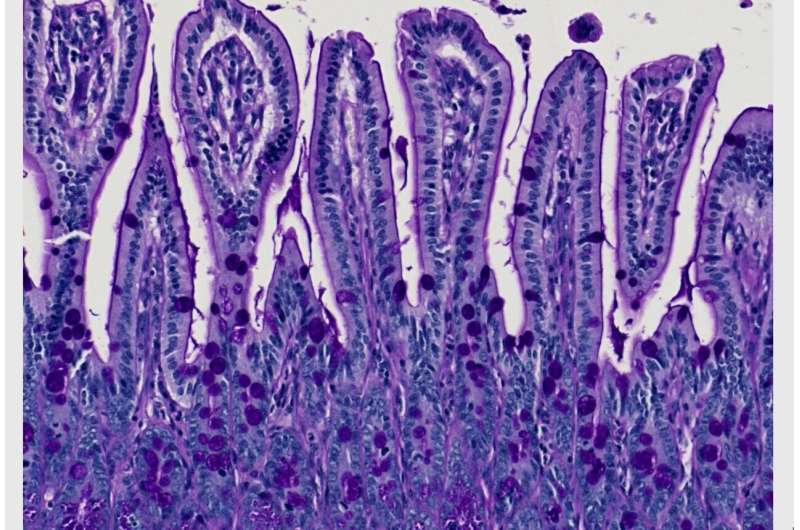
根据威尔康奈尔医学院和纽约长老会研究人员领导的一项新研究,单个基因的变化为有害肠道细菌打开了引发克罗恩病炎症的大门。这些发现有一天可以帮助医生更好地为患有这种免疫疾病的患者选择有针对性的治疗方法。
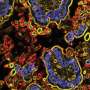
这种特殊的宿主基因被称为AGR2,它编码了细胞机制的一部分,帮助正确地制备新蛋白质,从而帮助击退“坏”细菌。从微生物到炎症条件破坏这一过程,蛋白质生产就会受阻,给细胞带来压力。agr2的极端表达——当它变得过于活跃或只是沉默——与这种压力和细胞对它的反应有关,并形成了11月15日在《柳叶刀》上描述的研究的基础细胞的报道.
研究人员已经怀疑细胞的应激反应在克罗恩病的发展中起着核心作用。除AGR2外,许多与克罗恩病相关的其他变体也参与了这种反应,据共同资深作者兰迪·朗曼博士说,他是胃肠病学和肝脏病学部门的医学副教授,也是威尔·康奈尔医学和纽约长老会/威尔·康奈尔医学中心吉尔·罗伯茨炎症性肠病中心主任。
他说:“这项研究的独特之处在于,我们发现了其中一种与压力相关的遗传易感性与导致这种疾病的肠道微生物群落变化之间的联系。”
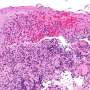
美国有超过50万人患有克罗恩病炎症性肠病(IBD)慢性炎症损害肠道内壁,通常在小肠和结肠。包括遗传易感性和某些细菌的存在在内的一些模糊的因素组合可以导致这种疾病。
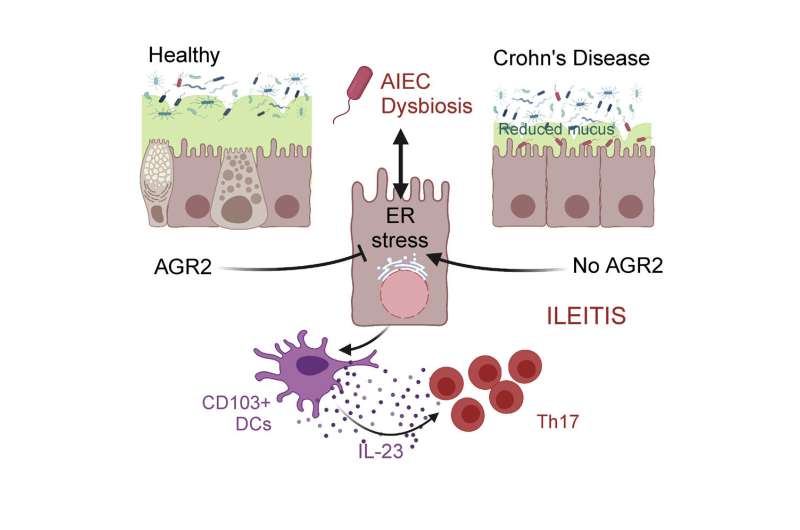
这项研究是偶然开始的,当时共同资深作者Steven Lipkin博士是威尔康奈尔医学院威尔医学系研究的副主席,也是纽约长老会/威尔康奈尔医学中心的医学遗传学家,他对小鼠进行了基因工程,以防止AGR2基因的表达,用于另一个项目,并发现它们患上了克罗恩病样炎症。他和他的合作者将这种炎症与粘附性侵入性大肠杆菌(AIEC)微生物联系起来,AIEC是与克罗恩病有关的细菌之一。
“我的实验室10多年前开始研究AGR2。现在,有400多篇关于该基因的论文,”利普金博士说,他也是威尔康奈尔医学院桑德拉和爱德华·梅耶癌症中心癌症遗传学和表观遗传学项目的负责人。“该基因驱动了与IBD、癌症转移和其他临床相关途径相关的重要途径,是一种有前途的精准医疗治疗靶点和共治疗未知者。”治疗不可知论是结合诊断和治疗的治疗策略。
利普金博士随后找到朗曼博士,后者研究这些细菌及其在克罗恩病中的作用。他们与康奈尔大学伊萨卡校区的肯尼斯·辛普森博士和北卡罗来纳大学的巴尔弗·萨托博士等合作团队一起,将AGR2活性水平的变化与AIEC所属细菌群的增加联系起来。然后在小鼠实验中,他们确定AIEC和错误的应激反应都是引发炎症的必要条件。更重要的是,他们的结果表明,改变的反应鼓励AIEC增殖,强化病理。
研究小组继续追踪这种相互作用引发的炎症途径。他们的实验将其与一种名为IL-23的免疫信号的产生联系起来,IL-23在克罗恩病中起着公认的作用。
利普金博士说:“IL-23是IBD和结直肠癌肿瘤发生的重要驱动因素,也是重要的治疗靶点。”“我们的研究有可能为IBD带来精准医疗,并为患者开发抗转移癌疗法。”
医生目前有许多治疗克罗恩病的方法,包括一些针对其复杂生物学的特定方面的方法。然而,他们几乎没有针对特定患者使用哪种治疗方法的指导。Longman博士说,通过将AGR2和AIEC与IL-23连接起来,这项研究提供了一种背景,可以帮助指导这些决定。