这篇文章已根据科学X的审查gydF4y2Ba编辑过程gydF4y2Ba而且gydF4y2Ba政策gydF4y2Ba.gydF4y2Ba编辑器gydF4y2Ba在保证内容可信度的同时,突出了以下属性:gydF4y2Ba
核查事实的gydF4y2Ba
同行评议的出版物gydF4y2Ba
可信的源gydF4y2Ba
校对gydF4y2Ba
对癌症突变的人工智能分析可能会改善治疗gydF4y2Ba
癌症有很多面——因此,致癌突变的范围也很大也就不足为奇了。这种个体基因组改变的总和被专家称为“突变景观”。这些景象因癌症类型的不同而不同。即使是患有同一种癌症的人也往往有不同的突变模式。gydF4y2Ba
研究人员已经对多种癌症的突变情况进行了分类。体细胞结构变异(sv)已被证明占所有癌症驱动的一半以上gydF4y2Ba突变gydF4y2Ba.这些是在生命过程中出现的细胞突变,比如在生命过程中复制错误悄悄进入DNAgydF4y2Ba细胞分裂gydF4y2Ba从而改变染色体结构。gydF4y2Ba
它们不是遗传的,只存在于受影响的细胞和细胞内gydF4y2Ba子细胞gydF4y2Ba.随着我们年龄的增长,这样的基因组改变变得越来越多,一个人的突变景观越来越像一个独特的马赛克。gydF4y2Ba
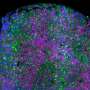
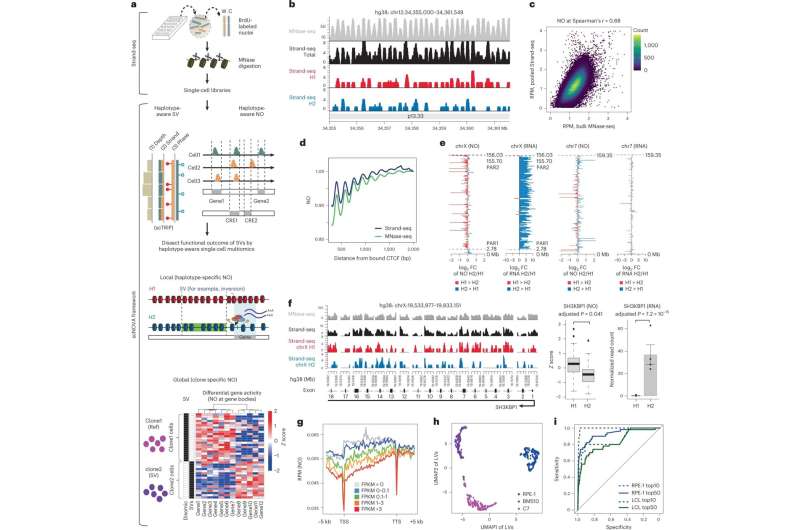
尽管体细胞sv在癌症发展中起着至关重要的作用,但对它们的了解相对较少。“目前还缺乏分析它们对细胞功能影响的方法,”Max Delbrück中心基因组稳定性和体细胞镶嵌实验室负责人阿什利·桑德斯博士解释说。由于桑德斯最近在杂志上发表的新研究发现,这种情况正在改变gydF4y2Ba自然生物技术gydF4y2Ba以及欧洲分子生物学实验室(EMBL)。gydF4y2Ba
她说:“我们开发了一种计算分析方法来检测和识别体细胞sv的功能影响。”这使研究小组能够了解不同白血病患者个体体细胞突变的分子后果,使他们对突变特异性改变有了新的认识。桑德斯说,也有可能利用这些发现来开发针对突变细胞的治疗方法,并补充说:“它们为个性化医疗开辟了令人兴奋的新途径。”gydF4y2Ba
甚至比传统的单细胞分析更详细gydF4y2Ba
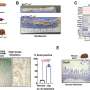
他们的计算基于strand -seq的数据,这是一种特殊的单细胞测序方法,桑德斯在开发过程中发挥了重要作用,并于2012年首次引入科学界。这项技术可以比传统的单细胞测序技术更详细地检查细胞基因组。gydF4y2Ba
得益于复杂的实验方案,Strand-seq方法可以独立分析父母的两条DNA链(一条来自父亲,一条来自母亲)。用传统的测序方法,区分这些同源物——形状和结构相似但不完全相同的染色体——几乎是不可能的。gydF4y2Ba
桑德斯解释说:“通过解析细胞内的个体同源物,可以比其他方法更好地识别体细胞sv。”研究人员和她的同事在《科学》杂志上发表的一篇论文中描述了这种方法gydF4y2Ba自然生物技术gydF4y2Ba在2020年。gydF4y2Ba
该研究团队是柏林卫生研究所(Charité (BIH), Charité-Universitätsmedizin柏林和Max Delbrück中心)联合研究重点“个性化医疗的单细胞方法”的一部分。gydF4y2Ba
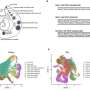
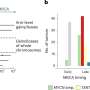
在这项工作的基础上,他们现在还能够确定核小体在每个细胞中的位置。核小体是包裹在组蛋白蛋白复合物周围的DNA单元,在染色体组织中起着至关重要的作用。核小体的位置可以在过程中改变gydF4y2Ba基因表达gydF4y2Ba,包裹的类型揭示了基因是否活跃。桑德斯和她的同事开发了一种自我学习算法来比较患者的基因活动gydF4y2Ba细胞gydF4y2Ba有或没有体细胞SV突变,使他们能够确定结构变异的分子影响。gydF4y2Ba
癌症治疗的新目标gydF4y2Ba
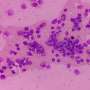
桑德斯解释说:“我们现在可以从病人身上提取样本,寻找导致疾病的突变,还可以了解致病突变破坏的信号通路。”例如,该团队能够在一位白血病患者身上识别出一种罕见但非常具有侵略性的突变。核小体分析为研究人员提供了有关信号通路的信息,他们使用这些信号通路专门抑制细胞的生长gydF4y2Ba细胞gydF4y2Ba包含突变。gydF4y2Ba
“这意味着一个单一的测试可以告诉我们一些有关细胞机制的信息gydF4y2Ba癌症gydF4y2Ba形成,”桑德斯说。“我们最终可以利用这些知识来开发个性化的治疗方法,以每个患者的独特情况为指导。”gydF4y2Ba
更多信息:gydF4y2BaHyobin Jeong等,单细胞结构变异的功能分析,gydF4y2Ba自然生物技术gydF4y2Ba(2022)。gydF4y2BaDOI: 10.1038 / s41587 - 022 - 01551 - 4gydF4y2Ba
Ester Falconer等人,单细胞DNA模板链测序在高分辨率绘制基因组重排,gydF4y2Ba自然方法gydF4y2Ba(2012)。gydF4y2BaDOI: 10.1038 / nmeth.2206gydF4y2Ba
阿什利D.桑德斯等人,单细胞分析结构变化和复杂重排与三通道处理,gydF4y2Ba自然生物技术gydF4y2Ba(2019)。gydF4y2BaDOI: 10.1038 / s41587 - 019 - 0366 - xgydF4y2Ba