结合多个地图揭示了导致失明的新的遗传风险因素
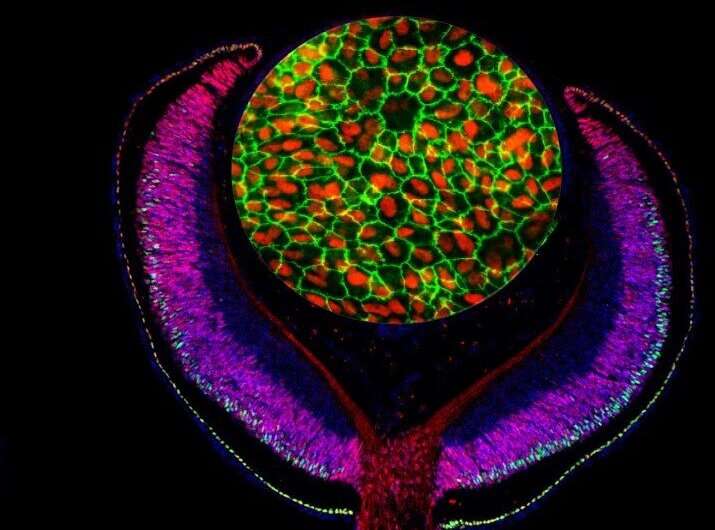
根据1月17日发表在开放获取期刊上的一项新研究,结合基因调节位点与疾病相关位点的地图,发现了成人发病黄斑变性(AMD)的一个新的遗传风险因素公共科学图书馆生物学由以色列特拉维夫大学的Ran Elkon和Ruth Ashery-Padan及其同事共同完成。这一发现促进了对成年人视力损害的主要原因的理解。
AMD是由视网膜色素上皮(RPE)功能障碍引起的,RPE是夹在接受光的感光细胞和滋养视网膜的绒毛膜之间的一层组织。由于RPE在AMD中的核心重要性,作者开始探索一种转录因子(一种调节AMD的蛋白质)特定的基因基于该团队对小鼠突变体的分析,LHX2是RPE发展的核心。他们发现,从人类干细胞中提取的RPE中的LHX2活性受到的影响最大基因下调,表明LHX2的作用可能是转录激活因子,与基因组上的调控位点结合以增加其他基因的活性。
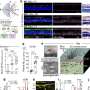
作者发现,一种名为OTX2的受影响基因与LHX2合作,调节RPE中的许多基因。通过绘制OTX2和LHX2可以结合的基因组位点,他们发现68%与LHX2结合的位点也与OTX2结合(总共864个位点),这表明它们可能共同促进参与RPE发育和功能的大量基因的活性。
寻找可能导致疾病的基因的一种常用方法是进行基因检测全基因组关联研究(GWAS),用于识别个体之间的基因组序列差异(称为GWAS)单核苷酸多态性或SNPs),与疾病同时发生。以前在AMD中已经做过许多这样的研究。然而,GWAS本身并不能揭示因果机制。在这里,作者将他们的LHX2/OTX2结合数据与GWAS数据进行了比较,以了解影响转录因子结合的变化,从而可能导致疾病。
其中一个这样的结合位点位于TRPM1基因的启动子区域内,该基因之前与AMD有关,并发现该位点的序列变异改变了LHX2的结合强度;所谓的C型结合比T型结合更强,当存在C等位基因而不是T等位基因时,TRPM1基因的活性更高。
研究结果表明,先前已知的由GWAS中鉴定的变异导致AMD风险增加是由于LHX2转录因子与TRPM1基因启动子的结合减少,从而导致该基因活性降低。该基因编码一个膜离子通道,之前的研究表明,该基因的突变也会导致视力损害。
作者说:“我们的研究举例说明了如何描述组织特异性转录调控因子,它们在基因组中的结合位点,以及它们的下游基因调控网络,可以为复杂疾病的病理提供见解。”
Ashery-Padan补充说:“这些发现揭示了由LHX2和OTX2组成的调节模块,控制视网膜色素上皮的发育和维持,这是视觉功能的重要组织。基因组分析进一步将两种发育因素结合的基因组区域与与年龄相关的常见多因素致盲疾病的遗传学联系起来黄斑变性(AMD)。”
更多信息:LHX2-OTX2转录调节模块控制视网膜色素上皮分化,并作为老年性黄斑变性遗传风险的基础,公共科学图书馆生物学(2023)。DOI: 10.1371 / journal.pbio.3001924