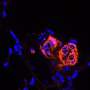
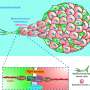
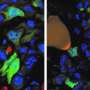
该策略可以消除肺癌细胞的转移特征和耐药性
韩国科学技术院(KAIST)生物脑工学教授赵光铉(音)领导的研究小组通过系统生物学研究,成功地改变了肺部致癌细胞的性质,消除了它们的耐药性和向身体其他部位扩散的能力。
癌症发病率在老龄化人群中增加。当早期发现不及时,在各个器官发生转移时,病死率特别高。为了解决这一问题,人们进行了一系列的尝试,以消除或降低的能力癌症细胞但它们导致处于中间状态的癌细胞变得更加不稳定,甚至更加恶性,这给治疗带来了严峻的挑战。
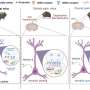
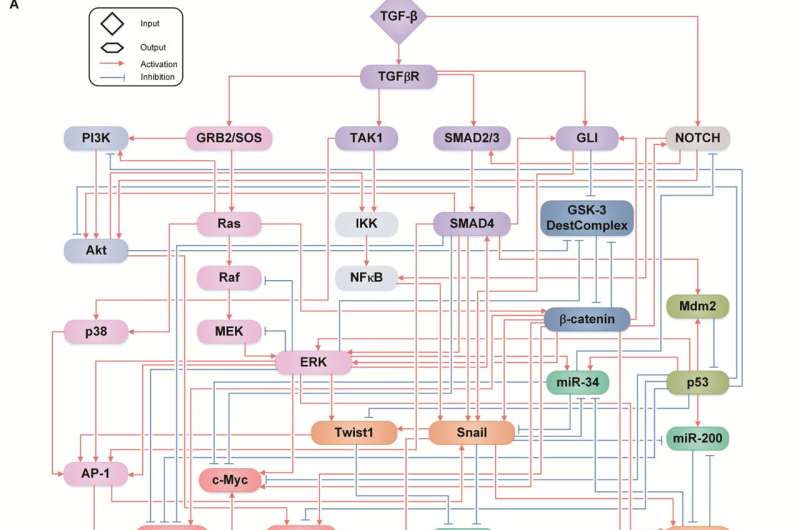
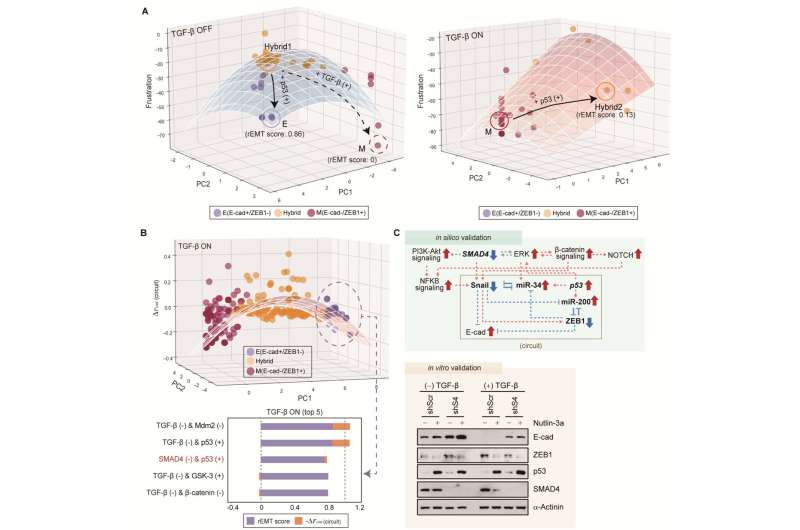
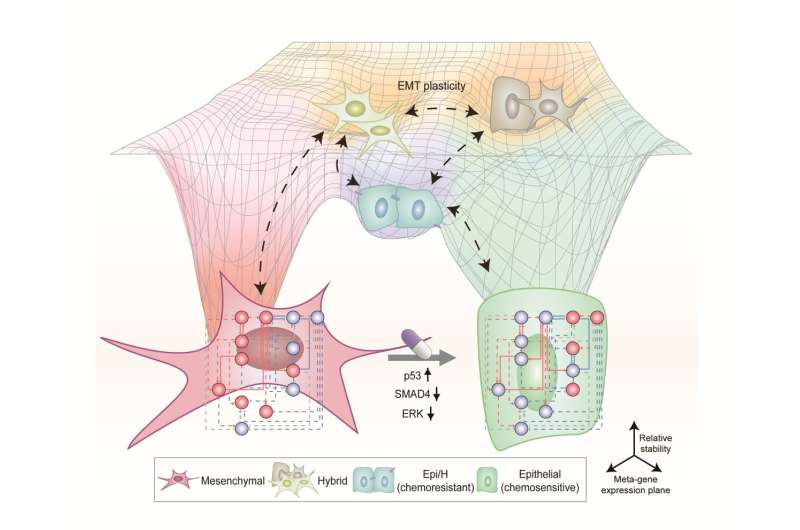
赵光贤教授组模拟了肺癌细胞的上皮细胞-间充质转化(epithelial -to- mesenchymal Transition, EMT)过程中,无转移能力的上皮细胞和有转移能力的间充质细胞之间的各种癌细胞状态。一个分子网络建立数学模型,通过计算机模拟分析和分子细胞实验,发现能够将已获得侵袭性和耐药性的间充质细胞状态逆转回上皮细胞的关键调控因子。
特别是,该过程成功地将间充质肺癌细胞恢复到对化疗敏感的状态,同时避免了中间过程中不稳定的EMT混合细胞状态,这一直是一个难题。
韩国科学技术院(KAIST)博士生金南熙、黄蔡英、金泰英、金贤珍等人参与的此次研究成果发表在了《科学技术院》杂志上癌症研究1月30日。这篇论文的标题是“细胞命运重编程策略逆转肺癌细胞的上皮细胞到间充质细胞的转变,同时避免混合状态。”
处于EMT混合状态的细胞是癌细胞在EMT过程中不完全转变引起的,它同时具有上皮细胞和间充质细胞的特征,通过获得高干细胞容量而具有高耐药性和转移潜力。特别是通过肿瘤微环境(tumor microenvironment, TME)分泌的转化生长因子-β (TGF-β)等因子进一步增强EMT,从而出现各种具有高度可塑性的细胞状态。
由于EMT的复杂性,在避免具有高转移能力和高耐药性的EMT混合细胞状态的同时,很难完全逆转间充质癌细胞向消除转移能力和耐药性的上皮细胞状态的过渡过程。
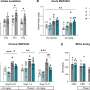
赵光贤教授的研究小组建立了一个数学模型进而应用大规模计算机模拟分析和复杂系统网络控制技术,对“p53”、“SMAD4”、“SMAD4”等基因调控网络进行了识别和验证。“ERK1”和“ERK 2”(统称ERKs)通过分子细胞实验作为三个关键分子靶点,可将肺癌细胞从间充质细胞状态,逆转回不再具有转移能力的上皮细胞状态,同时避免EMT杂交细胞状态。
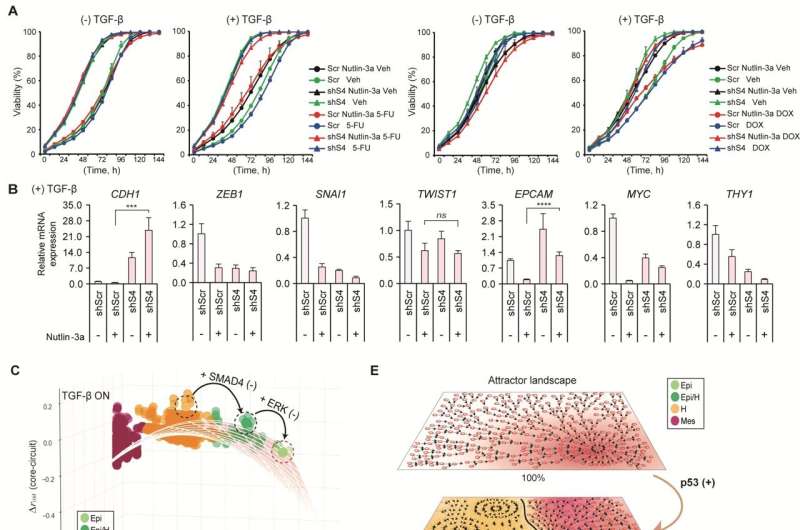
特别是,通过在系统水平上分析复杂EMT过程的分子调控机制,确定了与正反馈相关的关键通路,正反馈在癌细胞完全恢复到转移能力和转移能力的上皮细胞状态中起着重要作用耐药性是删除。
这一发现意义重大,因为它证明了间充质细胞能恢复到的状态吗上皮细胞在有TGF-β刺激的条件下,就像在人体内形成癌症组织的实际环境中一样。
癌细胞EMT异常会导致癌细胞的迁移和侵袭、对化疗的反应性改变、干细胞功能增强、癌细胞扩散等多种恶性特征。特别是癌细胞转移能力的获得是癌症患者预后的关键决定因素。本研究开发的肺癌细胞EMT逆转技术是一种新的抗癌治疗策略,可以对癌细胞进行重新编程,以消除其高可塑性和转移潜力,并增加其对化疗的反应性。
Kwang-Hyun Cho教授说:“通过成功逆转获得高转移性特征和药物耐药性的肺癌细胞状态,将它们恢复到对化疗重新敏感的可治疗上皮细胞状态,研究结果提出了一种新的治疗策略,可以改善癌症患者的预后。”
赵光贤教授研究组首次提出了将癌细胞恢复到原来状态的“逆转治疗”原理正常细胞此后,该公司于2020年1月宣布了将结肠癌细胞恢复为正常结肠细胞的研究结果,并于2022年1月成功地进行了重新编程研究,将最恶性的基底型乳腺癌细胞转变为可以用激素疗法治疗的低恶性管腔型乳腺癌细胞。
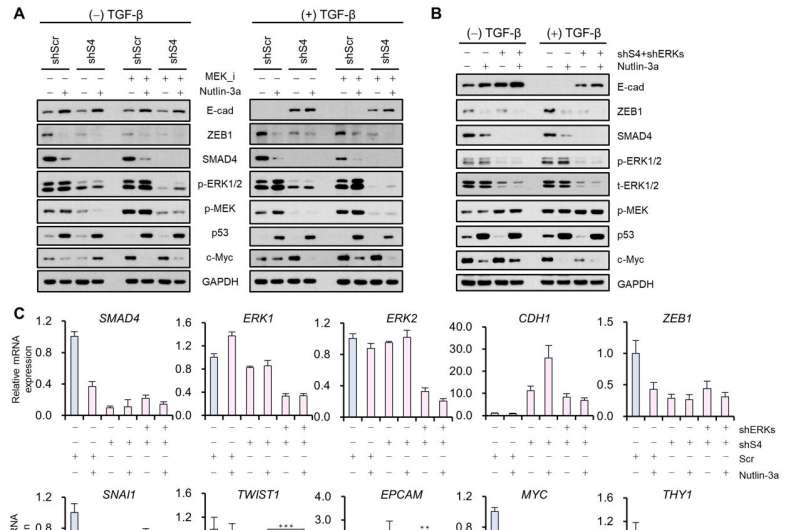
这一最新的研究成果是第三次在反转技术的发展中取得的肺癌细胞已经获得转移性特征的细胞回到一种状态,在这种状态下它们的转移能力被移除,药物敏感性增强。
更多信息:Namhee Kim等人,细胞命运重编程策略逆转肺癌细胞的上皮细胞到间充质细胞的转变,同时避免混合状态,癌症研究(2023)。DOI: 10.1158 / 0008 - 5472. - 22 - 1559