耐压力的胰腺癌肿瘤起始细胞显示驱动
加州大学圣地亚哥医学院的研究人员发现了一种分子通路胰腺肿瘤的起始的关键。的机制也可能导致疾病的高阻化疗和转移的倾向。
该研究发表在2023年1月16日自然细胞生物学发现,胰腺肿瘤启动细胞必须首先克服当地“隔离压力”通过创建自己的肿瘤促进微环境,然后招募周围细胞进入这个网络。针对肿瘤起源通路,新疗法可能会限制进展、复发和扩散胰腺癌。
胰腺癌症是最致命的癌症之一,众所周知的抵抗治疗。几乎所有病人经历癌症复发或转移。
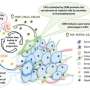
在肿瘤形成的早期阶段,癌症细胞(那些癌细胞突变,称为致癌基因)经验的损失向其他细胞和附着力细胞外基质——web包住的大分子和支持所有细胞。这种隔离会导致当地缺乏氧气和营养。大多数细胞不是孤立生存这样的压力,但是某一群细胞。
肿瘤起源细胞(TIC)在形成中发挥重要作用,肿瘤的复发和转移性传播。是什么使他们有别于其他癌细胞的韧性这些早期的不合格的条件。仙人掌在沙漠里一样,他们可以适应恶劣的环境并设置场景进一步肿瘤恶化。
“我们的目标是了解这些肿瘤起源细胞的特殊性质,是否我们可以控制癌症的生长和传播通过扰乱他们,“高级研究作者大卫说Cheresh,博士,特聘教授和副主席的加州大学圣地亚哥医学院病理学系和加州大学圣地亚哥分校摩尔癌症中心的一员。
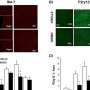
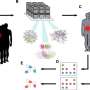
为了回答这些问题,第一作者Chengsheng Wu博士,博士后Cheresh的实验室,胰腺癌细胞系进行各种形式的压力,包括低氧和血糖水平。然后他发现细胞能够适应恶劣的环境条件和观察到的基因和分子在这些细胞被修改。
耐压力的肿瘤起源细胞表现出减少水平的肿瘤抑制微rna, mir - 139 - 5 - p。这反过来导致upregulation lysophosphatidic酸受体4 (LPAR4) G-protein-coupled受体在细胞表面。
“LPAR4不是通常发现快乐的细胞,但它被打开在压力环境中帮助细胞存活,这是特别有利的肿瘤起源细胞,”Cheresh说。
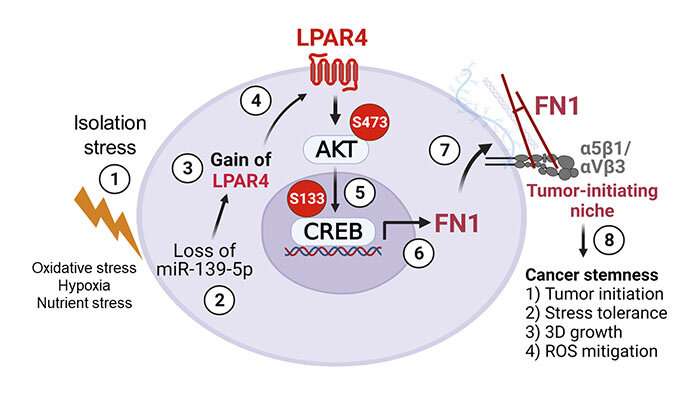
研究人员发现,LPAR4表达促进了新的细胞外基质蛋白的生产,让孤独的癌细胞开始构建自己的tumor-supporting微环境。
新的细胞外基质尤其是富含纤连蛋白,一种蛋白质,这种蛋白质跨膜受体结合称为整合蛋白在细胞周围。一旦这些细胞上的整合蛋白感觉到纤连蛋白,他们开始信号来表达自己的肿瘤起源细胞的基因。最终,这些招募了其他细胞纤连蛋白矩阵把肿瘤起源细胞和肿瘤开始形成。
“我们的发现为LPAR4建立一个关键的角色在胰腺肿瘤起始,和可能作用在其他上皮肿瘤,如肺癌、“Cheresh说。“这是中央肿瘤起源细胞的能力克服隔离压力和建立自己的利基,肿瘤形成。”
但隔离压力并不是唯一可以触发信号通路,研究人员说。化疗药物也旨在把癌细胞在压力之下。事实上,Cheresh治疗肿瘤细胞培养的研究小组发现,与标准治疗小鼠的胰腺肿瘤化疗也导致upregulation LPAR4。研究人员说,这或许可以解释这样的肿瘤细胞如何开发一个压力宽容和抵制毒品。
进一步的实验还表明,使用整合素拮抗剂阻断细胞利用纤连蛋白的能力矩阵反压力宽容的好处LPAR4表达式。因此,作者建议针对LPAR4通路或扰乱纤连蛋白/整合素相互作用可以有效预防增长,传播和胰腺肿瘤的耐药性。
“我们可以认为肿瘤起源细胞是在瞬态可以由不同的压力,所以我们临床的目标是阻止致癌细胞进入这种状态,“Cheresh说。“既然我们已经确定了途径,我们可以评估不同的方法我们可以干预。”
研究人员提出了一个新的药物针对这个途径可以作为预防高危患者的疾病,或以防止形成新的肿瘤转移的可能性高的癌症病例。
配对的新药与现有的化疗把压力放在成熟的肿瘤细胞也可以减少耐药性的影响,使癌症治疗更加有效,作者说。
“治疗癌症可以感觉有点像打鼹鼠,“Cheresh说,“但是如果我们有两个或三个锤子,我们知道摩尔会弹出下一步,我们可以打游戏。”
更多信息:大卫•Cheresh胰腺癌细胞移植LPAR4回应隔离压力促进肿瘤起始ECM-enriched利基和支持,自然细胞生物学(2023)。DOI: 10.1038 / s41556 - 022 - 01055 - y。www.nature.com/articles/s41556 - 022 - 01055 - y