探讨罕见遗传病的致病机制
Universitätsmedizin柏林,马克斯·普朗克分子遗传学研究所(MPIMG)和石勒苏益格-荷尔斯泰因大学医院(UKSH)详细调查了BPTA综合征,一种极其罕见的遗传性疾病是如何出现的。蛋白质电荷的变化会破坏细胞的自我组织,导致发育障碍。
研究小组还发现了数百种与各种疾病相关的可比较的基因变化,如大脑发育障碍和癌症易感性。这个机制,现在已经在杂志上被描述了自然,可能是许多无法解释的疾病和健康状况的原因。
数以千计的基因变化与各种疾病、失调和状况有关。但是,这些突变究竟是如何导致疾病的,目前还不清楚。这是因为这些变化涉及到具有无序三维结构的蛋白质片段,以及迄今为止所知甚少的细胞内功能。
医学和人类遗传学研究所的马丁·门萨博士在Charité网站上说:“很难研究这些蛋白质片段的作用,因为在许多情况下,它们必须与其他分子相互作用才能产生效果。”他是该研究的两位第一作者之一,也是数字临床科学家计划的研究员,该计划Charité与柏林卫生研究所(BIH)在Charité合作。
“以BPTA综合征为例,我们现在已经详细描述了蛋白质无序区域的变化如何导致遗传疾病。”这意味着研究小组发现了一种导致遗传疾病的新机制——而且,根据这项研究,令人惊讶的是,这种机制并不是那么罕见。
BPTA代表“短指畸形、多指畸形和胫骨再生不良/发育不良”。患者有严重的畸形,影响四肢、面部、神经系统、骨骼和其他器官。全世界有记录的病例不到10例,这使得这种疾病极其罕见。
为了确定这种综合征的原因,研究人员解码了遗传信息对其中5名受影响的患者进行了研究,并发现他们的HMGB1蛋白都发生了变化。由于所谓的移码突变,蛋白质结构的最后三分之一有一个正电荷而不是通常的消极。
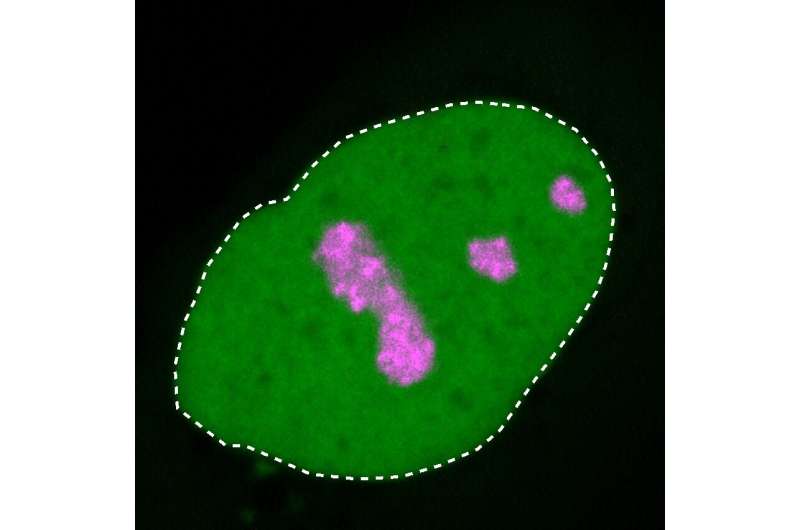
核仁凝固
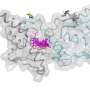
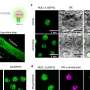
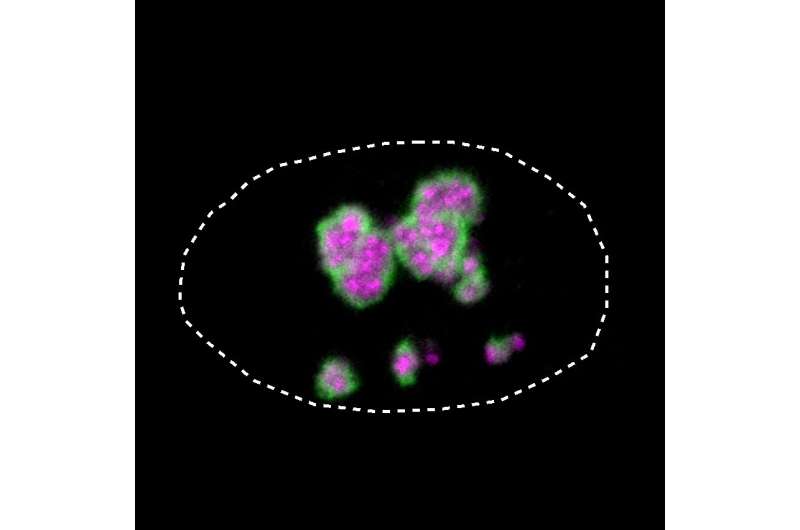
电荷的变化意味着HMGB1类似于倾向于聚集在核仁中的蛋白质,核仁是细胞核中的一个小区域,细胞的部分蛋白质工厂在这里组装。
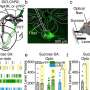
这种作用使得核仁对细胞的生存至关重要。研究小组根据分离出的蛋白质和细胞培养,突变的HMGB1蛋白,现在有一个带正电的末端部分,被不恰当地吸引到核仁。由于蛋白质的延伸也变得更硬,HMGB1蛋白质也聚集在一起。
MPIMG的研究员、该研究的另一位第一作者亨利·尼斯卡宁博士解释说:“在显微镜下,我们能够看到这导致核仁失去了自己的液体性质,变得越来越坚硬。”
核仁的凝固会对细胞的重要功能产生不利影响。在培养过程中,含有突变蛋白质的细胞比没有突变的细胞死亡更多。UKSH人类遗传学研究所所长、该研究的三位主要作者之一Malte Spielmann教授博士给出了他的结论:“我们展示了蛋白质无序部分的突变如何导致疾病。当电荷发生变化时,蛋白质错误地聚集在核仁中,对其重要功能产生不利影响。这就导致了有机体发育的紊乱。”
现有疾病的新解释
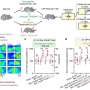
根据他们最初的发现,研究人员搜索了包含数千人DNA序列的数据库,寻找类似的病例。他们能够在66种蛋白质中识别出600多个突变,这些突变导致了基因的最后一部分蛋白质既有正电荷,也有更硬的性质。在这些突变中,有101个之前与各种疾病有关,包括神经发育障碍和癌症易感性增加。
对于13种选定的蛋白质,研究小组研究了细胞培养,以确定突变是否使它们对核仁具有特殊的亲和力。其中12人都是这样。测试的蛋白质中约有一半损害了核仁的功能,因此它们与BPTA综合征的疾病机制相似。
“导致这种情况的机制疾病我们在BPTA综合征中发现的,也可能与许多其他疾病和病症有关,”该研究的主要作者丹尼斯·霍恩教授说,他在Charité的医学和人类遗传学研究所工作。“所以我们打开了一扇门,可以帮助解释许多其他疾病。真正的工作现在才开始。”
新发现的机制也可能导致新的治疗方法,至少对某些疾病而言。“肿瘤可归因于基因变化MPIMG一个研究小组的负责人、该研究的第三位主要作者丹尼斯·尼兹博士解释说。“这意味着我们可能能够通过干预细胞的自组织来预防癌症的发展,这种自组织是由蛋白质的无序部分介导的。”
更多信息:罕见遗传病中异常相分离和核仁功能障碍,自然(2023)。DOI: 10.1038 / s41586 - 022 - 05682 - 1.www.nature.com/articles/s41586 - 022 - 05682 - 1