在癌细胞分泌的一种蛋白质的帮助下,肿瘤内的“死亡区域”促进了癌症的扩散

弗雷德·哈钦森癌症中心(Fred Hutchinson Cancer Center)的研究人员在大鼠身上进行的一项新研究表明,肿瘤的坏死核心含有促进肿瘤细胞转移或在全身播撒肿瘤细胞的因子。
研究人员希望他们的研究结果将发表在2月27日那周的《科学》杂志上美国国家科学院院刊,使人们更好地了解如何治疗转移性癌症,即4期癌症,这是可以治疗但无法治愈的。
“肿瘤坏死核是一种相当常见的现象,但直到最近它们才与癌症转移联系起来,”在张实验室工作的弗雷德·哈奇研究生Ami Yamamoto说。“我们的研究将其他人对乳腺癌转移的具体情况的观察结合在一起。我们的研究显示了坏死,循环肿瘤细胞还有癌症转移。”
什么是死区
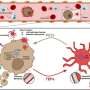
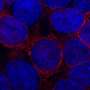
坏死核是由内而外死亡的肿瘤,它们为癌症扩散创造了完美的环境。
山本说:“肿瘤的死亡区域有血管泄漏、缺氧或低氧水平以及免疫细胞的招募,其中一些已被证明有助于癌细胞扩散。”“我们认为正在发生的事情是,坏死的核心大部分是一个死亡区域,但它也有一些幸存下来肿瘤帮助癌细胞在体内扩散的细胞。”
外科医生、病理学家、放射科医生、临床医生和研究人员在他们的工作中经常遇到坏死的核心,这通常不是一个好兆头。
该研究的资深作者、Fred Hutch医生兼研究员Kevin张医学博士说:“坏死是一种在快速生长的侵袭性肿瘤中看到的临床发现。”“当我们在病人的活组织检查中看到它时,这意味着这是一个危险的肿瘤,需要积极治疗。”
但张表示,坏死不仅出现在大型晚期肿瘤中。它可能发生在早期,也可能发生在小肿瘤中。
一种与坏死和癌症扩散有关的蛋白质
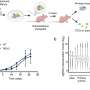
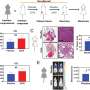
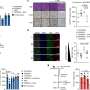
弗雷德·哈奇团队开发了一种新的乳腺癌转移大鼠模型,以研究肿瘤的坏死核心。在几周的时间里,山本追踪了循环肿瘤细胞(ctc)的进展,这是癌细胞是否逃逸到血液中扩散到全身的一种衡量标准。在前两个时间点(第13天和第17天),他们发现没有ctc,但在第四个时间点(第27天),情况发生了变化。
“突然间,我们发现了数百个ctc,”山本说。她把年的增长联系起来癌症细胞与原发肿瘤形成大面积中心坏死时一样。
进一步的调查显示出明显的差异基因表达在肿瘤的坏死和非坏死区域之间。
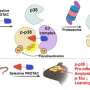
山本说:“我们发现,一种编码血管生成素样7(一种分泌蛋白)的基因是肿瘤坏死区和坏死区附近最丰富的肿瘤源性基因。”
研究人员发现,这种单一的蛋白质,血管生成素样7,重塑肿瘤微环境以某种方式鼓励肿瘤细胞生长超过它们的营养极限,发生坏死并开始扩散到身体的其他部位。
张说:“这真是个惊喜。”“我们认为坏死是完全不受控制的,不是你可以控制的。”
山本接着做了实验,看看控制这种蛋白质会如何影响坏死。
山本说:“当我们抑制肿瘤中这种蛋白质的表达时,坏死肿瘤面积显著减少。”“抑制类血管生成素7,或A-7,也将循环肿瘤细胞减少到几乎为零,并减少远处转移和扩张的大血管。”
山本说,他们的研究不仅显示了A-7调节心脏中央坏死的发展原发肿瘤以及血管扩张的发展,这可能有助于循环肿瘤细胞的扩散和转移。
一个潜在的治疗靶点
除了如此重要的坏死机制之外,这些发现还揭示了一种新的靶向治疗患者的潜力。
她说:“我们的最终目标是开发一种针对a -7的治疗性抗体,以预防或减少转移性乳腺癌患者的转移。”
为此,该团队已经提出了200多种抗a -7抗体的候选抗体,但需要对所有抗体进行筛选,以确定哪些抗体在阻断该功能方面表现最好。张说,他和他的团队还想分析大型患者队列的数据,以更好地了解肿瘤坏死和转移扩散风险之间的作用。
“一些患者有证据的标记坏死在他们的血液里,”他说。“这表明,这种情况不仅可能发生在临床前模型中,也可能发生在患者身上。”
张和Yamamoto还想深入研究那些悬而未决的问题。
张说:“在我们开始这项研究之前,我们可能认为坏死核心是肿瘤中最无趣的部分。”“我们现在相信,对于研究转移性癌症的来源来说,细胞内部是一个非常有趣的地方。还有更多的癌症生物学在等着我们。”
更多信息:Yamamoto, Ami等人,乳腺癌来源的血管生成素样7调控肿瘤内部的转移和坏死核心的形成,美国国家科学院院刊(2023)。DOI: 10.1073 / pnas.2214888120.doi.org/10.1073/pnas.2214888120