FAM3C被包裹在循环肿瘤来源的细胞外囊泡中促进肺癌的远处生长
转移,癌症扩散到其起源部位以外的过程,与不良的临床预后,癌症死亡率和治疗耐药性有关。特别是非小细胞肺癌(NSCLC),具有很高的转移潜力,是世界上死亡率最高的癌症。因此,了解驱动转移的分子基础(到目前为止仍不清楚)是很重要的,以便设计早期干预的治疗方法。
在这项研究中,由新加坡国立大学新加坡癌症科学研究所的Goh Boon Cher教授领导的一组研究人员和临床医生发现,从肿瘤中释放的细胞外囊泡(ev)可能负责引入生长和生长转移受体细胞的电位。
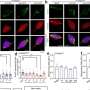
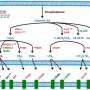
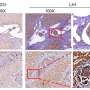
通过无偏蛋白组质谱分析肿瘤源性ev,研究小组发现了一组丰富的负载分子,其中包括由白细胞介素样EMT诱导物(ILEI)编码的FAM3C蛋白在NSCLC肿瘤中过表达,这与不良临床结果密切相关癌症转移。
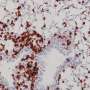
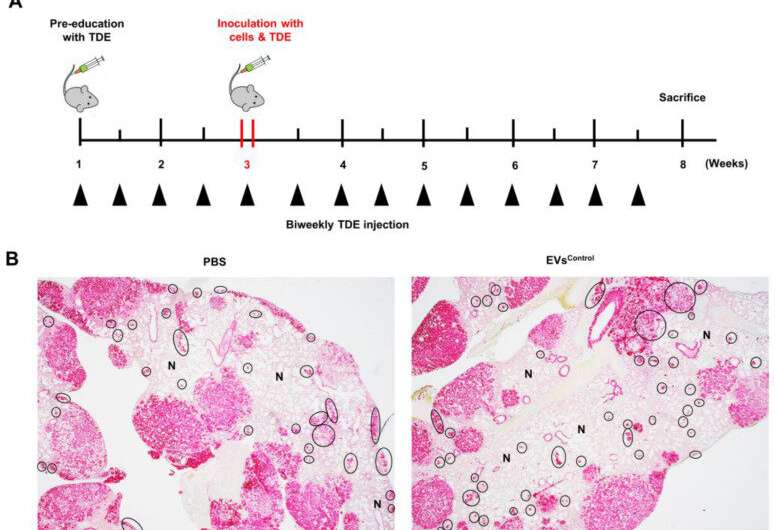
在临床前模型中,FAM3C在肺癌细胞中的异常表达增强了细胞转化并刺激了远处肺肿瘤定植。更重要的是,研究人员发现了在ev中涉及FAM3C的一种以前未知的微环境串扰模式,在这种模式中,FAM3C通过肿瘤衍生ev (TDEs)的传递和摄取促进了受体细胞中的致癌信号。他们的研究结果发表在开展.
研究人员的发现有助于阐明以前不甚明确的由FAM3C驱动的致癌和转移机制。此外,该研究通过演示ev的细胞间串扰,扩展了目前关于细胞自主致癌信号的知识。虽然这项研究集中在肺癌,这可能与FAM3C高表达的其他癌症有关,特别是在癌症患者的ev中。
进一步研究FAM3C在其他癌症中的作用将对规划治疗策略非常有益,因为基于血浆ev中FAM3C表达的患者分层可能为制定针对广泛肿瘤转移的治疗策略铺平道路。
更多信息:Win Lwin Thuya等,循环肿瘤来源的细胞外囊泡中的FAM3C促进非小细胞肺癌在次要部位的生长,开展(2023)。DOI: 10.7150 / thno.72297