科学家们使用新的电学方法来观察老年痴呆症的“临界点”
科学家们还不清楚tau蛋白是如何从一种对我们大脑正常功能至关重要的良性蛋白质变成有毒的神经纤维缠结的,而神经纤维缠结是阿尔茨海默氏症和其他神经退行性疾病的标志。
但是加州大学圣巴巴拉分校的研究人员开发的一种新方法能够实时控制和跟踪它发生的过程。该技术采用了一种新颖的低压电作为触发脑电波的自然信号的替代品蛋白质折叠:折叠和组装,既为了其在大脑中的正常功能,也为了导致致命疾病的失控过程
生物化学和分子遗传学荣誉教授丹尼尔·e·莫尔斯说:“这种方法为科学家提供了一种新的手段,可以触发并同时观察蛋白质从好到坏的动态变化。生物化学杂志.
“这种方法应该广泛适用于识别分子和条件,这些分子和条件在许多不同但相关的淀粉样蛋白疾病中指导不同的组装轨迹,”Eloise Masqulier说,她是来自哈佛大学的学生、研究人员和教师组成的跨学科团队的主要作者分子生物学包括Esther Taxon、梁生平、Yahya Al Sabeh、Lior Sepunaru和Michael J. Gordon。
在正常情况下,tau是一种可溶性蛋白质,一开始是开放、松散的结构,就像一根绳子。在对信号的响应中,tau蛋白折叠并逐渐相互组装,使它们能够结合到微小的圆柱形结构——微管——支撑神经元的形状,并在细胞内运输营养物质和分子。然而,在病理病例中,信号走得太远,导致蛋白质不受控制地组装,形成不溶性淀粉样丝,变成神经原纤维缠结在神经元内部,打断它们的功能,最终杀死它们。
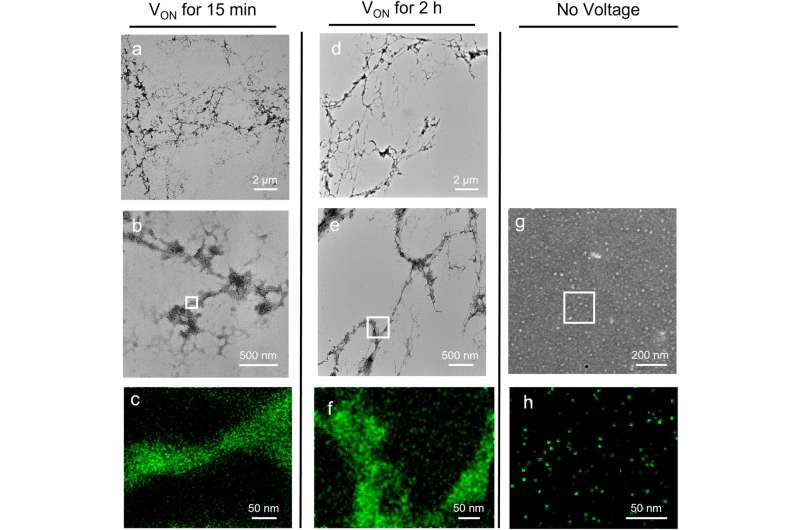
使用他们的新方法对tau的核心部分(一种肽)进行研究,研究人员能够观察和分析正常、可逆的折叠和组装之间的关键“临界点”,以及构成tau病的不可逆、病理组装之间的临界点,神经退行性疾病.利用不到一伏的电势来模拟过度磷酸化(促进疾病的信号),科学家们在实验室实验中触发并微调tau肽的折叠,使用光谱方法揭示折叠和渐进组装的细节,形成淀粉样蛋白丝。
不像其他的考试方式蛋白质折叠和组装,如x射线衍射或冷冻电子显微镜该电化学方法提供了过程的静态快照,因为他们发生的时间,新的电化学方法允许用户连续见证和分析渐进的动态折叠和组装的细节,因为他们实时发生,允许在这些过程中关键的最早步骤的第一次直接观察。此外,与以前用于研究tau及其核心肽的大多数技术不同,由于电触发密切模仿自然触发信号,该方法允许直接观察这些过程,而不需要额外的“辅助”分子。
作者报告说,这项技术还可以作为一种工具,更快速地测试和识别可能对预防或治疗阿尔茨海默病和其他淀粉样蛋白疾病有用的药物和抗体。
莫尔斯解释说:“因为我们可以随意启动和微调这个过程,我们可以使用这个系统来看看哪些分子可以阻止或阻止折叠和组装的特定阶段。”
更多信息:Eloise Masquelier等人,一种新的电化学方法,模拟核心tau肽K18的磷酸化,能够对中间体和组装进行动力学和结构分析,生物化学杂志(2023)。DOI: 10.1016 / j.jbc.2023.103011