小分子药物逆转adar1诱导的癌症干细胞克隆能力
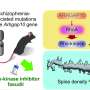
加州大学圣地亚哥分校医学院、桑福德干细胞研究所和摩尔斯癌症中心的研究人员报告称,一种名为rebecsinb的晚期临床前小分子抑制剂可以逆转一种炎症诱导蛋白亚型(ADAR1 p150)的恶性超编辑。ADAR1的这种恶性蛋白亚型在20种不同的癌症类型中促进免疫沉默、转移和治疗耐药性。
研究结果发表在细胞干细胞.
ADAR1蛋白参与了RNA的变化,RNA是DNA的化学表亲。具体来说,它将rna的组成部分腺苷改变为另一种组成部分,称为肌苷。这个过程被称为A-to-I编辑。
正常情况下,ADAR1参与控制先天免疫反应——身体对外来入侵者的早期反应。由ADAR1进行的A-to-I编辑改变了人体RNA的某些方面,使其不会受到免疫系统的攻击。ADAR1还被认为可以通过修改某些病毒的RNA来抑制它们的复制和传播,如人类免疫缺陷病毒和丙型肝炎病毒。然而,肆无忌惮的ADAR1过度表达允许癌症细胞逃避宿主的先天免疫反应
Jamieson和同事先前的研究表明,恶性微环境中的破坏性炎症信号会导致ADAR1p150过表达,诱导慢性髓系白血病(CML)和某些造血(血)干的恶性重编程祖细胞会导致白血病前期疾病的发展,比如骨髓纤维化急性髓系白血病(AML)。此外,ADAR1p150还在20种不同的恶性肿瘤中成为治疗耐药性的驱动因素和免疫消声器。
AML和CML都是相对不常见的癌症,但都可能致命,尤其是继发性AML (sAML), 5年生存率仅为26%。根据现有的最新数据,超过一半的患者在诊断后的第一年死于sAML(2017年21380例新病例中有10590例死亡)。
资深研究作者Catriona Jamieson医学博士、加州大学圣地亚哥分校桑福德干细胞研究所所长、加州大学圣地亚哥分校摩尔斯癌症中心副主任、加州大学圣地亚哥分校医学院医学教授说:“尽管分子靶向治疗取得了进展,但死亡率在40多年来基本保持不变。”
“ADAR1诱导的炎症细胞因子诱导的A-to-I超编辑与AML、CML、多发性骨髓瘤、骨髓纤维化和14种不同实体肿瘤类型的治疗耐药性有关。”
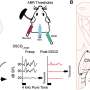
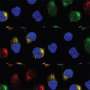
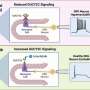
在最新的研究中,Jamieson和合著者试图确定恶性ADAR1剪接的具体驱动因素,以及它是否可以逆转。他们使用发光萤火虫荧光素酶和绿色荧光蛋白技术和检测工具开发了一种非侵入性成像工具,然后观察到雷贝西尼抑制了sAML人源小鼠模型中的恶性ADAR1剪接。
“我们的目标是停止癌症才能起飞,”贾米森说。“在这些研究中,瑞贝西尼似乎在阻止和逆转ADAR1超编辑方面具有巨大潜力,ADAR1超编辑导致从非侵入性癌前到能够抵抗治疗、逃避免疫和转移的侵入性癌症。”
作者指出,在已完成的研究前新药申请(IND前)动物研究中,利贝西尼已被证明具有良好的耐受性和有效性,目前正在进行IND使能研究。
Jamieson说:“这项研究为瑞贝西尼的临床开发奠定了基础,它是一种有前途的方法,可以消除高风险sAML和骨髓纤维化患者的治疗耐药和复发。”
更多信息:Leslie A. Crews等人,rebecsinb逆转恶性ADAR1剪接亚型转换,细胞干细胞(2023)。DOI: 10.1016 / j.stem.2023.01.008