是什么使血液干细胞转化?RNA剪接的调控可能是一个答案
隆德大学医学院的研究人员已经确定了一种新的机制,将核糖核酸的代谢与骨髓增生异常综合征(MDS)患者白血病的发展联系起来。在该杂志上发表的一项研究中分子细胞,他们解释了是什么使造血干细胞在癌症中获得恶性特征。
RNA剪接是基因表达调控的主要纽带,在发育过程中塑造细胞特性,在人类癌症中经常发生改变。这一过程是由一种被称为剪接体的复杂分子机制介导的,它能够从单个基因中产生多种功能不同的蛋白质。
由Cristian Bellodi博士领导的一组研究人员最近发现了一种硬连接遗传控制机制,调节个体剪接体成分,称为剪接因子,在细胞中含有常见的致癌病变人类癌症.
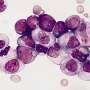
这项工作强调了包括SF3B1在内的核心剪接蛋白在各种癌症中经常发生突变。剪接因子突变在MDS中尤其普遍,MDS是一组异质血液学疾病,其特征是有缺陷的血液干细胞和白血病发展的高风险。“越来越多的证据强调了异常剪接在癌症中的作用,即使没有剪接因子突变。然而,我们对非突变剪接因子在肿瘤进化中的作用知之甚少。”
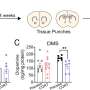
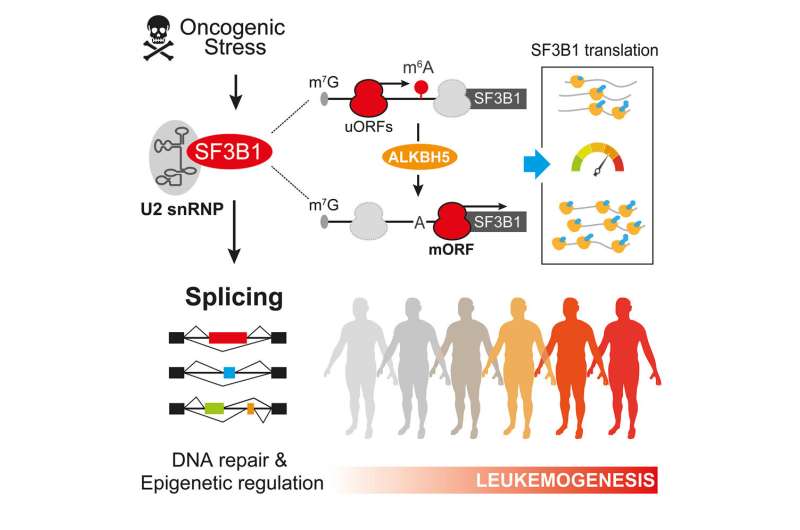
研究小组首先研究了非突变的SF3B1(一种核心剪接体成分)的水平如何导致MDS疾病。与卡罗林斯卡学院Eva Hellström-Lindberg教授的团队一起,Maciej ciemla及其同事发现了SF3B1水平在MDS向白血病恶性转化过程中的动态调节。
“引人注目的是,我们发现SF3B1蛋白在MDS患者体内积累,通过剪接调控来确保基因组完整性。阻断这一机制极大地加速了侵袭性白血病的进展,”隆德大学干细胞中心RNA和干细胞生物学小组的博士后、该研究的第一作者、波兰IMOL的小组负责人Maciej ciemola说。
作者进一步研究了在向白血病转变过程中控制SF3B1产生的分子决定因素。这些研究导致了突破性的发现,SF3B1的合成依赖于一个单一的RNA化学修饰标记,称为n6 -甲基ladenosine, m6A,沉积在其信使RNA上。
“我们发现m6A RNA修饰的存在提供了一个‘停止信号’,调节SF3B1的产生,这是一个影响DNA损伤积累的关键事件白血病细胞ciekella解释道。
“我们的研究结果揭示了白血病干细胞中RNA代谢和基因组完整性之间新的关键联系,为MDS患者癌症发展的复杂潜在机制提供了重要的见解。我们的发现非常及时,因为越来越多的证据表明RNA修饰和剪接改变代表了治疗血液病和实体癌患者的新治疗漏洞,”隆德大学分子血液病和隆德干细胞中心副教授Cristian Bellodi总结道。
更多信息:m6a驱动的SF3B1翻译控制引导剪接以指导基因组完整性和白血病发生分子细胞(2023)。DOI: 10.1016 / j.molcel.2023.02.024