研究人员详细开创性:Angelman综合征发展

德州农工大学的研究人员已经开发出第一种分子治疗:Angelman综合征推进到临床的发展。
在一个新文章今天发表在科学转化医学Scott Dindot博士,副教授和边研究员德州农工大学兽医学院的医学和生物医学科学”(气体)兽医病理学部门,和他的团队分享的过程他们开发了这部小说治疗候选人,也称为4.4.PS。L,或gtx公司- 102。Dindot也在Ultragenyx分子遗传学的执行董事,这是主要的发展,gtx公司- 102。
如Angelman综合征()是一个毁灭性的,罕见的neurogenetic疾病影响到大约15000年活产每年;引发的障碍是孕产妇的功能的丧失UBE3A基因在大脑中,导致发育迟缓,如果没有演讲,运动或平衡障碍和癫痫发作。
没有批准的治疗,和当前的护理重点是标准行为疗法和控制特定的症状,特别是常常影响患者的癫痫发作。
在健康个体,复制的UBE3A表达的基因遗传自母亲的大脑和副本UBE3A基因遗传自父亲是被另一个基因,称为UBE3A反义(UBE3A-AS)记录。个人生活的突变影响产妇的表达式或函数的副本UBE3A因此,他们缺乏UBE3A蛋白质在他们的大脑。Dindot和他的团队开始他们的研究寻找一种方法来阻止父亲的沉默UBE3A基因的激活表达缺乏蛋白质。
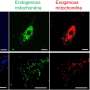
在他们的研究中,Dindot和他的团队使用不同的基因组的方法来了解UBE3A-AS大脑中的转录调控。他们发现了一个前所未知的地区工作UBE3A-AS他们认为代表了基因在哺乳动物的祖先起源。他们还认为这一地区在调节中扮演着重要角色的表达UBE3A-AS。
“这个地区的部分保持不变3000万多年,“Dindot说。“UBE3A-AS记录是一个极其复杂的基因。它是什么,以及它是如何监管已争论多年。”
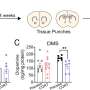
然后团队开发了反义寡核苷酸(ASOs) -由DNA和rna合成分子目标守恒的地区UBE3A-AS成绩单。麻生太郎药物通过绑定到目标RNA和削减,导致基因停止制造RNA。
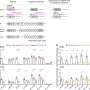
研究小组发现,ASOs针对守恒的地区有效关闭UBE3A-AS反过来,重新激活的表达父亲的姓氏UBE3A等位基因。研究表明,ASOs重新激活了父亲的表达UBE3A等位基因和增加UBE3A蛋白质在培养神经元从个人。
由于这项研究,Dindot发达铅化合物称为gtx公司- 102,这是现在临床开发。
“我们曾经设计ASOs的新颖的方法,针对一个特定基因的一部分,而不是给予药物治疗症状,”Dindot说。“从理论上说,这种治疗后的核心条件。”
临时数据从一个阶段1/2 gtx公司- 102的临床试验在美国,英国和加拿大曾表明,化合物已经证明在儿科患者患有“有意义的改善”。
“前进,我们的研究,发现不仅提供承诺,也为发展提供前进道路麻生太郎治疗其他遗传疾病,“Dindot说。
更多信息:斯科特诉Dindot et al,麻生太郎治疗:Angelman综合征,目标一个进化保守地区的UBE3A-AS成绩单,科学转化医学(2023)。DOI: 10.1126 / scitranslmed.abf4077