研究人员发现有希望的新目标耐药性乳腺癌和卵巢癌
铜博尔德研究人员发现一种蛋白质的重要角色在帮助乳房和卵巢肿瘤生存和发展,发现抑制蛋白质杀死癌细胞而不损害健康的。
周二发表的一项研究发现,在《华尔街日报》4月12日分子细胞,找到一种有前景的治疗癌症的新目标了基因突变,包括BRCA1和BRCA2基因突变。研究可能会导致新疗法,有更少的副作用,对癌症,已经对现有的治疗方法。
每年约250000名妇女被诊断为乳腺癌,另有20000人被诊断为卵巢癌。多达80%的妇女最常见的一种卵巢癌了抗药性。
“这是一个重要的突破这些女性抵抗癌症和来说,我们现在没有更多的报价,”资深作者说Nausica Arnoult,助理教授的分子,细胞和发育生物学在铜博尔德。
抗击癌症的新方法
研究围绕着所谓的DNA损伤反应,所有细胞中检测到损伤机制的双链螺旋携带遗传指令并采取措施修复磨损的目的。
“我们的DNA来自太阳的不断被破坏,我们呼吸的化学成分和内部流程,我们和所有生物进化机制快速修复损伤,”Arnoult说。
当修复机制是错误的,因为当人们继承BRCA1或BRCA2基因的变异副本,一些细胞犯错误和突变复制,可能导致不可控的细胞生长或癌症。突变也可以偶尔发生,由于环境因素或其它因素。
具有讽刺意味的是,同样的错误的修复机制,也可以导致癌症形成使癌细胞本身容易受到破坏。
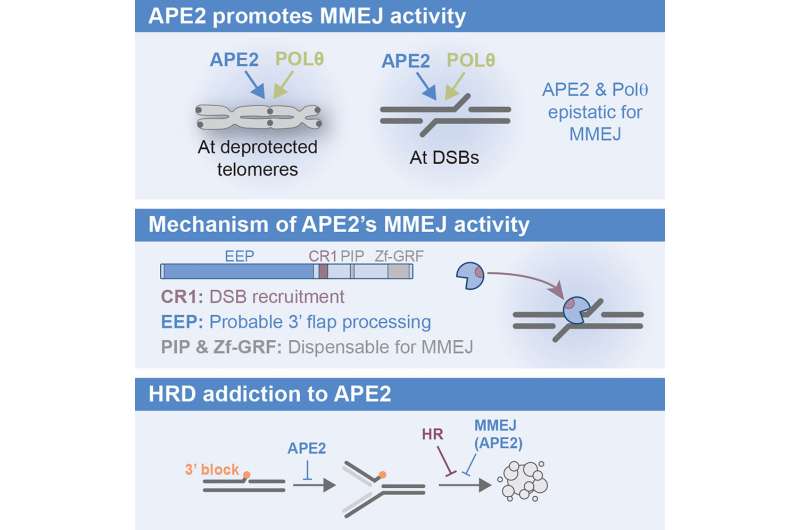
大约一半的卵巢癌和四分之一的乳腺癌一线DNA修复机制,缺乏一个关键同源重组(人力资源),必须依靠一个不太可靠的途径被称为MMEJ (microhomology-mediated结束加入)。
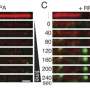
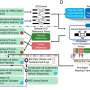
希望开发方法禁用,备份路径,Arnoult和她的团队开始更好地理解它。他们在实验室里观察到破坏癌细胞致力于自我修复和利用蛋白质的基因编辑工具CRISPR隔离在起作用。
他们发现,一种叫做APE2起着重要作用的蛋白质在肿瘤细胞DNA修复破碎的。当他们基因抑制它,DNA损伤反应摇摇欲坠,癌细胞死亡。
与此同时,健康细胞,可以依靠他们一线DNA损伤反应,不需要APE2,毫发无损。
“我们表明,抑制APE2选择性地杀死癌症细胞在不影响正常组织和可能是一个强大的目标来对抗乳腺癌和卵巢癌,”Arnoult说。
她的团队并不是第一个DNA损伤后去回应脆弱一些癌症的“阿喀琉斯之踵”。
自2015年以来,成千上万的卵巢癌和乳腺癌患者已经接受所谓的“PARP抑制剂”,如重磅炸弹药物olaparib,作品通过禁用不同备份DNA自我修复途径。
Arnout说,不幸的是,许多癌症已对这类药物,促使科学家们去寻找其他途径和目标。
在未来的研究中,她试图确定一个小分子,可以抑制APE2。这样一种抑制剂可能是考虑到改善结果或与其他药物耐药性发生时作为第二选择。
Arnoult说,许多不同种类的癌症突变,使他们容易受到抑制其他DNA修复的因素。通过更好地了解这些不同的通路,科学家可以开发新的,广泛的抗癌症的靶向治疗。
“我们不能把所有的鸡蛋放在一个篮子里,”她说。“对很多妇女来说,一旦癌症成为耐药,没有二线治疗。我们需要改变。”
更多信息:休伯特Fleury et al, APE2核酸酶至关重要的DNA双链断裂修复microhomology-mediated加入,分子细胞(2023)。DOI: 10.1016 / j.molcel.2023.03.017