扩大细胞间交流驱动器胰腺癌的早期发展,发现新的研究
讨论癌症通常压力,导致疾病的基因突变通过改变细胞的正常功能的蛋白质。喀斯特,例如,通常作为一个开/关开关为细胞增殖,但突变gene-common在肺癌、结直肠癌和胰腺癌cancer-cause切换到留任。
但突变只是故事的一半。
这些之间的相互作用基因突变和外部因素,如组织损伤,导致炎症,重塑细胞的身份和当地环境的方式促进癌症的出现和失控的增长。
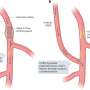
在胰腺癌速度,这些变化开始发生组织损伤后24至48小时。他们可以预见发生。他们极大地扩展一些细胞的沟通和互动的能力附近的细胞。
这是5月11日发表的一份新研究的结果科学由调查人员领导的一个国际研究小组斯隆凯特林研究所纪念斯隆凯特林癌症中心(MSK)和IRB巴塞罗那。研究结合成熟的转基因小鼠模型和先进的计算方法来地图最早的细胞状态导致胰腺导管腺癌(PDAC),最常见的胰腺癌。
虽然五年存活率胰腺癌近年来一直缓慢上升,仍很找到12%,根据胰腺癌行动网络。疾病通常不是抓住,直到在晚期癌症,这在一定程度上要归功于进步在治疗其他类型的癌症,胰腺癌是癌症死亡的第三大原因。
目的研究不仅揭示了困难的研究课题产生胰腺癌早期细胞事件,但也发现潜在的机会医学干预在疾病的早期阶段。
可塑性如何驱动癌症
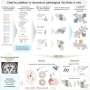
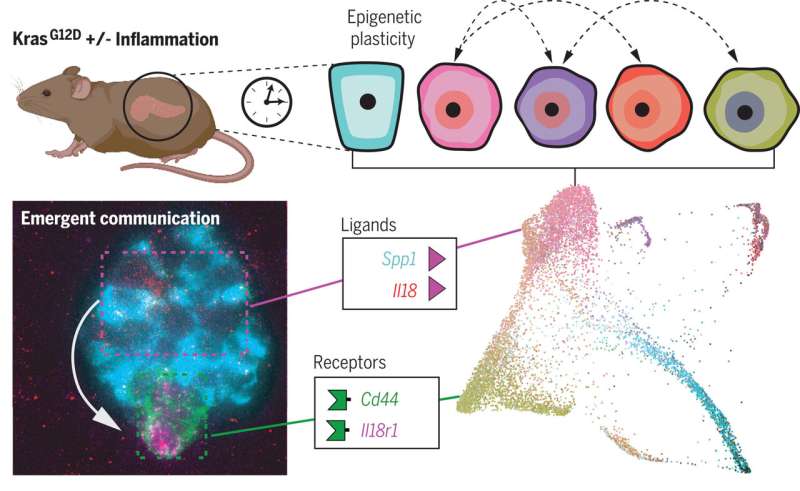
细胞能够摆脱原有身份和适应称为可塑性。这种可塑性增强炎症,研究人员发现。
“这些癌前细胞获得能够发送和接收信号远比一个正常的细胞,”达纳Pe怎样计算生物学家说,博士论文的两位作者之一。“我们看到,这不是随机的结构。你看到相同的模式出现,当您运行实验在不同的老鼠。”
co-first领导的这项研究是作者卡桑德拉Burdziak, Pe怎样实验室博士生,和Direna Alonso-Curbelo,博士,文章的第二作者实验室的前成员斯科特•劳博士,目前自己的实验室IRB巴塞罗那。
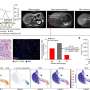
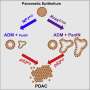
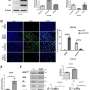
为了研究可塑性的起源和影响细胞上表达的变异版本喀斯特,科学家们进行了单细胞分析正常,发炎,癌变前的和恶性组织使用转基因小鼠模型,旨在准确重建的许多方面在人类胰腺癌转移的最早起源。
“这些模型允许我们捕捉最早胰腺上皮细胞的变化从一个健康的发展状态走向恶性状态,”劳博士说,霍华德·休斯医学研究所研究员兼斯隆凯特林癌症生物学和遗传学项目研究所。单细胞分析允许研究人员梳理胰腺内的单个细胞群体的特点,在每个阶段的进展和他们互动如何进一步推动发展。
创新”这个项目需要大量的计算,其中大部分由卡桑德拉,”笔记Pe怎样,也是霍华德·休斯医学研究所研究员和计算和系统生物学项目负责人斯隆凯特林研究所。“我们发明了一种新方法来回答问题,不是通常被问及可塑性,细胞间通信,和肿瘤恶化。”
例如,团队发明了一种新的分类评分来测量细胞的可塑性。
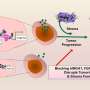
领导的研究小组还发现,增加可塑性相关基因的增强细胞间通信:那些编码配体和受体。
“基本上,这些基因使细胞发送和接收信号与其他细胞,从它的环境和“体育怎样说。”这使细胞能够响应信号,正常细胞就不能。他们也有一个与免疫细胞,增强沟通能力,因此,免疫系统在这些细胞开始改变。”
此外,研究人员能够确定的细胞群体,他们中的一些人非常罕见,转化为主要沟通的枢纽,驾驶反馈回路,导致胰腺癌的开发和发展。
这项研究是研究的顶峰发起Alonso-Curbelo博士,曾长期兴趣详细的分子机制促进癌症引发炎症。
“这项工作是一个真正的伙伴关系实验科学和计算科学,“Alonso-Curbelo博士说。
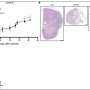
计算模型与后续实验验证。“例如,成像表明细胞的数量计算方法互相交谈说明显接近彼此的组织,“Burdziak说。
通过进一步的实验,团队能够证明这些对话推动癌症发展。
“我们专门开发了新的小鼠模型来阻断细胞间信号与肿瘤相关的可塑性,“Alonso-Curbelo博士说。“这些分析表明,这些广阔的通信网络直接在小鼠胰腺肿瘤形成。”
向临床应用
作为一个整体,研究提供了一个新的,详细了解细胞如何携带KRAS基因的变异副本获得可塑性和驱动癌症时受到炎症的进展。
“这提供了一个路线图,可以帮助开发策略检测甚至预防胰腺肿瘤之前达成不可治愈的阶段,”劳博士说。”,了解细胞间通讯网络驱动的起始胰腺癌的前景发展的治疗阻止或早期癌症进展缓慢,甚至可能更先进的疾病。”
更多信息:卡桑德拉Burdziak et al,表观遗传可塑性合作与信息交互直接胰腺肿瘤发生,科学(2023)。DOI: 10.1126 / science.add5327