科学家发现的肿瘤抑制机制

p53基因在人类基因组中是最重要的一个:唯一的p53蛋白的作用,这种基因编码是当肿瘤形成和杀死它。虽然基因被发现超过四十年前,研究人员至今未能成功确定究竟怎么回事。现在,在最近的一项研究发表在癌症的发现,威斯塔研究所的研究人员已经发现了一个关键机制是如何p53抑制肿瘤。
通过使用p53的基因变异和比较这变种未能完成的健康的野生型p53基因可以做,研究人员发现p53触发免疫功能的机理,进而杀死肿瘤。
“思考模式的转移是,而不是问“p53做什么”我们能够使用lesser-functioning但癌症诱发基因变异在非裔美国人告诉我们什么p53不做当它不抑制癌症吗?”莫林·e·墨菲博士说,这篇论文的主要作者,艾伦和罗纳德·卡普兰癌症中心副主任和Ira Brind教授和程序的领袖威斯塔研究所分子和细胞瘤形成程序。
四个半几百万美国人拥有继承,或生殖系,p53的突变,增加癌症的风险。这些人有一个突变的一个小子集导致李Fraumeni综合症,导致他们开发多个肿瘤每隔几年,从童年。
其他人有不同的p53突变具有所谓的亚等位基因:一个基因变异有相似但较弱的影响比相应的正常,或野生型基因。这些人也患上癌症,但他们不那么咄咄逼人,他们开发它。
墨菲和她的团队决定了解p53抑制肿瘤通过探索一个特定亚等位基因无法抑制。研究人员选择了一个非洲特殊变体叫做Y107H因为非洲美国人最大的癌症世界上任何民族的负担。
他们的第一个假设是,他们可以用“下游”的亚等位基因发现基因——p53通常会是抑制肿瘤的关键。他们的第二个假设是,他们可以筛选药物,会杀死亚等位基因肿瘤:墨菲的集团能够实现两个目标。
研究人员开始利用CRISPR工程小鼠模型的非洲特殊亚等位基因Y107H。正如所料,老鼠与Y107H发达许多形式的癌症和与人类拥有这种变体,他们开始在“中年”(即罹患癌症。12 - 14个月后,平均两年寿命)。
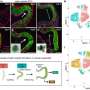
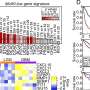
接下来,研究人员创建的肿瘤细胞系与他们Y107H亚等位基因,以及亚等位基因的细胞系中发现德系犹太人人口,称为G334R。然后相比哪些基因被正常打开,或野生型p53(抑制肿瘤),但不能打开这两个亚等位基因(未能抑制肿瘤)。PADI4基因符合这些条件。确认,他们检查的其他10个hypomorphs-none变体打开PADI4,。
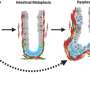
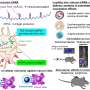
“好像这是关键目标基因p53,每次您患上癌症的基因变异,它不能打开这个基因,”墨菲说。她还说,PADI4会牵连,是有道理的,因为这个基因可以帮助免疫系统识别肿瘤。它通过修改组件的肿瘤蛋白质,使他们成为瓜氨酸,这是一个非天然的氨基酸。当免疫系统识别瓜氨酸作为一种异物,它的攻击。
“基本上,当肿瘤细胞从一个细胞到两个不应该,p53是惊慌,它取决于PADI4, PADI4说,‘免疫系统,你最好再来找我,”墨菲说。
墨菲的最后阶段的研究超越了基础研究和帮助癌症患者。首先,研究人员利用纯种的分子筛查和蛋白表达的工具来识别药物会对肿瘤的有效Y107H亚等位基因的同时,仍能保留与野生型p53肿瘤。
然后,他们寻找一种方法来预测哪些病人会对免疫疗法,不会做出回应。通常,为了做到这一点,他们需要更多的人类组织样本的非裔美国人比他们。所以,他们变成了机器学习。
”进入Noam Auslander博士,他是一个杰出的人工智能机器学习的人在纯种,”墨菲说。”她说,“让我找到的基因p53和PADI4控制一起使用生物信息学方法和创建一个基因签名。”
为此,Auslander TCGA数据库中分析了60000个肿瘤,确定五个基因一起coregulated通过野生型p53和PADI4 Y107H亚等位基因无法打开。进一步分析后,她发现这这预测癌症生存,免疫渗透进入肿瘤,谁会应对免疫疗法。
墨菲认为,确定这种基因签名通过机器学习就是把她的团队的论文从医学改变的科学突破。“我们不仅说我们有一个重要的目标基因p53,但我们也有一个重要的这五会告诉我们谁会回应免疫疗法,谁不会,和p53的核心这个签名。”
她还认为,这一研究可以只执行了一个机构像纯种,因为合作很重要。“如果你看看作者在这,我有免疫学家做了免疫学;我有机器学习的人做了生物信息学;我和药物筛选人复合屏幕,”墨菲说。“威只是一个令人兴奋的地方,这里的每个人都说,‘这就是我可以帮助你的研究。它使所有的差异。”
更多信息:亚历山德拉Indeglia et al,非洲特殊变体TP53揭示PADI4 p53-mediated肿瘤抑制的监管机构,癌症的发现(2023)。DOI: 10.1158 / 2159 - 8290. - cd - 22 - 1315