研究揭示了机制h . pylori-induced胃癌
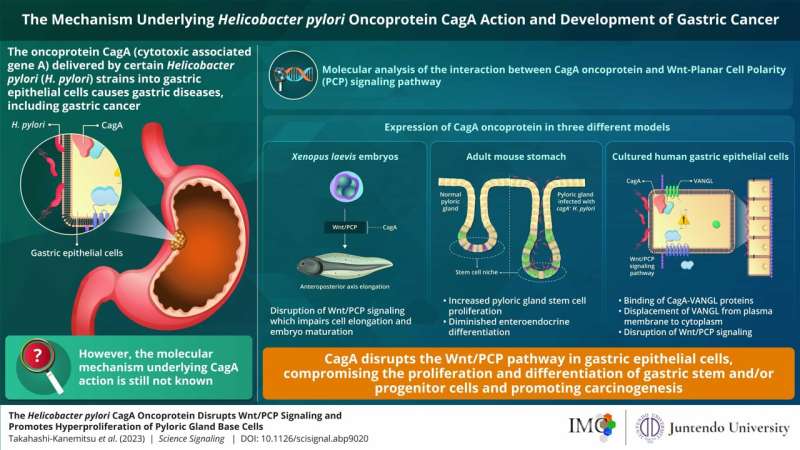
幽门螺杆菌(幽门螺旋杆菌)感染通常伴有腹痛、腹胀和酸度。临床证据显示,感染幽门螺杆菌cagA+压力大大增加患胃癌的风险。
专门的蛋白质由幽门螺旋杆菌宿主,肿瘤蛋白”CagA”,已被证明与多个宿主蛋白质,促进胃致癌作用(正常细胞的转变癌症细胞)。然而,与它相关联的潜在机制的生化活动尚未完全确定。
一项新的研究发表在科学的信号2023年7月18日股见解的额外的致癌机制CagA行动。
“CagA与多个宿主蛋白质在胃上皮细胞内,从而诱导通路与肿瘤形成和促进胃致癌作用。我们想找出哪些途径参与了这一过程,”Atsushi Takahashi-Kanemitsu博士说,该研究的第一作者和助理教授,生物化学系&系统生物医学,顺天堂大学,当他追求本研究的动机。
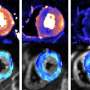
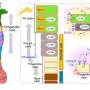
为了开展他们的研究中,研究人员表示肿瘤蛋白在三种不同的非洲爪蟾蜍models-embryos CagA光滑的(实验室青蛙),人工培养的胃上皮细胞和成年小鼠的胃,试图了解其影响宿主细胞和途径。
的团队指出,表达CagA x光滑的胚胎癌蛋白导致损伤胚胎发育过程中观察到的收敛扩展movements-cell运动参与塑造或延伸有机体的组织和器官。这障碍进一步干扰后续关键胚胎发育过程,包括身体轴形成。
同样,团队使用成年老鼠进行实验。他们产生转基因小鼠(转基因),具体表达CagA癌蛋白在胃上皮细胞在回应他莫昔芬治疗。
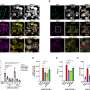
研究人员发现CagA表达式在成年小鼠的胃造成幽门glands-secretory腺体的深度的增加,促进消化/胃功能,也引发了异常细胞增殖过度,这是一个现象明显观察到各种类型的癌症。这也导致了位移的蛋白质“VANGL1/2”(Van Gogh-like (VANGL)蛋白家族,扮演关键角色在不同的生物进程在质膜的细胞质。
CagA表达式也导致更少的分化enteroendocrine细胞,胃肠道中特殊细胞,帮助消化。
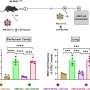
最后,团队表示CagA癌蛋白在人类胃上皮细胞培养。的实验清楚地表明一个小区域CagA癌蛋白相互作用氨基酸残基VANGL1/2的蛋白质,从而导致其位移(这种现象也观察到小鼠模型)和导致破坏Wnt / PCP路径a关键生物“接力”,影响发展。
通讯作者Masanori畠山直哉,实验室负责人,学院微生物化学、微生物化学研究基础上,说,“摄动Wnt / PCP信号由幽门螺杆菌CagA-VANGL交互产生增生性改变,随着受损细胞分化在胃幽门腺。结合其他致癌CagA行动,这可能导致的发展胃癌。"
总之,研究人员得出结论,在这项研究中,他们能够阐明分子机制参与胃幽门螺旋杆菌引起的致癌作用,获得洞察Wnt / PCP通路在癌形成的作用,并提出作为一个潜在的目标对幽门螺杆菌cagA临床干预措施+感染。
更多信息:Atsushi Takahashi-Kanemitsu,幽门螺杆菌CagA癌蛋白破坏Wnt / PCP信号和促进幽门腺基细胞的增生,科学的信号(2023)。DOI: 10.1126 / scisignal.abp9020