研究目标突变导致胰腺癌
经过30年的令人沮丧的结果在试图开发药物抑制突变蛋白与一些更具挑战性的癌症治疗,对RAS蛋白的研究正在蓬勃发展。
新发现有修订RAS的观念是一种无药可治”“个人目标或RAS突变是无法区分的效果,说音乐目的就是癌症中心研究员约翰·奥布赖恩,博士学位。
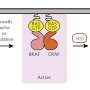
奥布赖恩,与他长期研究伙伴Shohei Koide,博士,主任癌症生物制剂在纽约大学Langone波尔马特癌症中心,和其他合作者在目的和波尔马特,已经添加了越来越多的知识与他们发展的合成monobodies不仅附加喀斯特(G12D),一个特定的RAS突变中常见的胰腺癌、肺癌和结肠直肠癌,但也抑制一些喀斯特(G12D)的行动。
至关重要的是,他们使用的方法来开发monobodies提供了一个蓝图瞄准其他突变目前被认为无药可治”。”
针对喀斯特
RAS蛋白生化开/关开关控制信号对许多生长因子和激素受体。
“这是一个非常重要的信号继电器的细胞,”奥布赖恩表示。但突变意味着拉被困在“开”的位置,导致增长失控,最终,癌症。
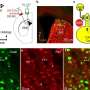
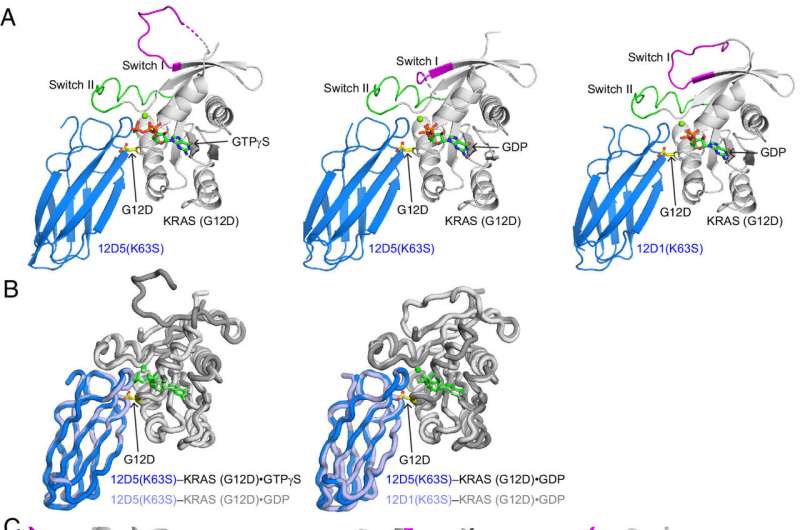
奥布赖恩在RAS和Koide已经一起工作了十多年。在他们的论文中发表的美国国家科学院院刊》上他们这些合成monobodies以及报告的结构隐藏口袋喀斯特(G12D),研究人员针对作为抗癌药物的秘密入口。
“当你monobody,你不知道它会做什么,”奥布赖恩解释道。“它可能只是绑定,没有任何效果。但事实证明,几乎所有的monobodies我们RAS抑制,这意味着它们绑定到必需的重要地区,RAS的功能。所以,先证明他们选择性地结合,抑制RAS,然后确定它们绑定,我们可以了解这些地区的RAS蛋白的功能是很重要的。”
RAS突变出现在所有的约20%人类癌症,奥布赖恩说,但是可以在90%以上的胰腺导管腺癌(PDAC),最常见的胰腺癌。
“拉实际上是一个司机的肿瘤。这是PDAC形成的初始的事件之一,”奥布赖恩说。
他们的出版正值RAS的理解是跳跃前进。在过去的两年里,美国食品和药物管理局已经批准了两个肺癌药物目标喀斯特(G12C),另一个频繁的RAS突变蛋白。今年,一个药物的早期临床试验针对喀斯特(G12D)开始。,药物的发展仅仅是有可能的,因为工作的Kevan gosper Shokat,博士,谁发现了隐藏的口袋里,这些药物目标,奥布赖恩表示。
奥布赖恩Koide,然而,开始他们的工作之后才知道,隐藏口袋里,通过排序monobodies库。
“原来我们monobody结合在口袋,打开它更多,”奥布赖恩表示。”这表明,可能会有一些使用该信息的方法在药物设计和开发。”
在他们的论文中,研究人员还描述如何隐藏口袋是结构化的,他们认为提供了重要的数据点的发展下一代喀斯特(G12D)抑制剂。
他们还认为,蛋白质工程技术用于开发monobodies可以用来对付其他具有挑战性的目标,最终被证明是一种更简单的方式。
尽管奥布赖恩和Koide PNAS抛光他们的论文,对拉继续他们的工作,单独和在一起。
奥布赖恩最近被美国国防部授予资助工作交付monobodies进入肺部作为潜在的治疗,他正在与亚伦霍布斯,博士的目的就是科学家,他的研究重点是喀斯特(G12R)在胰腺癌。
更多信息:莲花Akkapeddi et al,探索开关II口袋构象的喀斯特(G12D) mutant-selective monobody抑制剂,美国国家科学院院刊》上(2023)。DOI: 10.1073 / pnas.2302485120